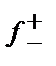КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Активтік коэффициент
|
|
|
|
ТАРАУ
Ерітіндідегі реакциялардың жалпы сипаттамасы
3.1. Химиялық тепе-теңдік, әрекеттесуші массалар заңы. Тепе-теңдік константалары
Аналитикалық химияда пайдаланылатын реакциялардың көпшілігі қайтымды, яғни реакция бір уақытта қарама-қарсы, тікелей және кері, бағытта жүреді:
А +В ↔ С + Д
Қайтымдылық белгісі (↔). Екі қатар жүретін реакцияның солдан оңға қарай жүретінін (→) тікелей реакция, ал оңнан солға қарай (←) жүретінін кері реакция дейді.
Массалар әрекеттесу заңы бойынша химиялық реакцияның жылдамдығы реакцияға қатысатын заттардың концентрациясының көбейтіндісіне пропорционалды. Массалар әрекеттесу заңы тұрғысында тікелей реакцияның жылдамдығы υт:
υт = kт [А]·[В] (3.1)
Квадратты жақшамен заттың молярлы (моль/дм3) сәйкес концентрациясы белгіленеді. kт – дегеніміз пропорционалды кэффицент, ол реакция жылдамдығының концтантасы деп аталады. Егер А мен В мәні 1 моль/дм3 тең болса онда
υт = kт
Демек жылдамдық константасы деп реакцияға қатысатын әр заттың концентрациясы 1 моль/дм3 болғандағы реакцияның жылдамдығын айтады. Бұл мән заттардың химиялық табиғаты мен температураға байланысты, ал концентрацияға байланысты емес.
Кері реакцияның жылдамдығы υк:
υк = kк[С]·[D] (3.2)
Реакция басталғанда А мен В концентрациялары С мен D-ның концентрацияларына қарағанда көп. Сондықтан (3.1) және (3.2) тендіктері бойынша тікелей реакцияның жылдамдығы кері реакцияның жылдамдығына қарағанда басым болады. Реакцияның жүруі нәтижесінде А мен В-ның концентрациялары азаяды да, С мен D-ның концентрациялары артады. Осының нәтижесінде тікелей реакцияның жылдамдығы ептеп кемиді, ал кері реакцияның жылдамдығы артады. Соңында екі реакцияның жылдамдығы теңеседі:
υт = υк (3.3)
Бұл жағдайда А, В, С, D концентрациялары өзгермей қалады, яғни жүйеде химиялық тепе-теңдік орнайды. Тепе-теңдік орнағанда реакцияға заттардың қанша молекулалары қатысса, сонша молекулалары кері реакцияның нәтижесінде түзіледі, демек қозғалмалық, не динамикалық тепе-теңдік пайда болады.
(3.3) теңдікке (3.1), (3.2) теңдіктерден υт, υкмәндерін қойсақ
kт[А]·[В] = kк[С]·[D]
Енді концентрациялардың мәндерін теңдіктің бір жағына, тұрақты мәндер kт, kк – екінші жағына шығарсақ:
[С]·[D] / [А]·[В] = kт/kк
Екі константалардың қатынасы kт/kктұрақты мән болғандықтан, оны К деп белгілесек (kт/kк=К):
[С]·[D] / [А]·[В] = К (3.4)
Егер қайтымды реакцияның теңдігін жалпы түрде жазсақ аА+вВ↔сС+dD,тепе-теңдік орнағанда:
[С]с·[D]d / [А]а·[В]в = К (3.5)
Химиялық тепе-теңдік орнағанда реакцияның нәтижесінде пайда болған заттардың концентрацияларының көбейтіндісінің реакцияға қатысқан заттардың концентрацияларының көбейтіндісіне қатынасы тұрақты сан, олтепе-теңдік константасы деп аталады (К). Концентрациялар реакцияның стехиометриялық коэффиценттеріне сәйкес дәрежелерде алынады.
К – реакцияның концентрациялық тепе-теңдік константасы – Кk. Тепе-теңдік константасының мәні температура мен қысымға тәуелді, ал реакцияға қатысатын заттардың концентрацияларына байланысты емес.
Тепе-теңдік константасыkт/kк қатынасына тең болғандықтан, ол тұрақты жағдайда тікелей реакцияның жылдамдығы кері реакцияның жылдамдығынан қанша рет басым екенін көрсетеді. К-нің сандық мәнінен реакцияның жүру бағытын анықтауға болады. Егер тепе-теңдік константасы К өте үлкен болса (К>І), онда реакция аяғына шейін жүреді, кері реакция жүрмейді десе де болады. Яғни бұл жағдайда тепе-теңдік оң жаққа ығысқан. К-ның мәні өте аз болғанда (К< І) кері реакцияның жүруі басым болады да, тепе-теңдік солға ығысады. Тепе-теңдік константасы бірдің шамасында боланда (К=1) реакция қайтымды деп есептеледі. Тепе-теңдік орнағанда реакцияға қатысқан барлық заттардың концентрациялары әжептәуір, екі реакцияның біреуі де басым жүрмейді.
Анализ жүргізгенде химиялық реакцияның аяғына дейін жүргені қажет. Тепе-теңдік константасын және тепе-теңдікті ығыстыру мүмкіншіліктерін пайдаланып рекцияны қажетті жаққа ығыстырып жүргізуге болады. Ол үшін реакцияласатын заттың біреуін артық мөлшерде құяды, не реакцияның нәтижесінде пайда болған бір затты реакцияласу қабілеттігі жоқ түрге ауыстырады. Мысалы:
СоCl2+4NH4SCN ↔ (NH4)2[Co (SCN)4] +2NH4Cl
Реакцияның тепе-теңдігі орнаған жүйеге NH4SCN артық мөлшерін құйсақ тепе-теңдік оңға қарай ығысады. Бұл ығысу мына қатынас
[(NH4)2Co (SCN)4] . [NH4Cl]2 / [СоCl2] . [NH4SCN]4
тепе-теңдік константасына теңескенше жүреді. Осы сияқты реакцияның нәтижесінде пайда болған кобальттың тиоцианатты (роданидті) комплексін органикалық еріткішпен экстракциялап, реакцияласатын жүйеден алып кетсе де тепе-теңдік бұзылып, реакция солдан оңға қарай жаңа тепе-теңдік орнағанша жүреді.
Қайтымды реакцияны аяғына дейін жүргізу үшін пайда болған заттың біреуін газ, нашар еритін тұнба, не аз диссоциацияланатын қосылыс түрінде үзбей жүйеден алып кету қажет.
Химиялық термодинамика бойынша тепе-теңдік орнағанда жүйеде энергиясы ең аз мән болады. Бұл энергия жүйенің бос энергиясы деп аталады (Гиббс энергиясы) және G=H–ST теңдігімен анықталады. (G – жүйенің бос энергиясы; Н пен S –жүйенің энтальпиясы мен энтропиясы; Т- абсолютті температура.). Тепе-теңдік константасы мен Гиббс энергиясы арасындағы байланысты көрсететін теңдік:
∆G0 = -RTlnK lnK = ∆G0/RT
∆G – стандартты Гиббс энергиясының өзгеруі.
Келтірілген теңдеу стандартты Гиббс энергиясы өзгеруінің сандық мәнін пайдаланып тепе-теңдік константасын және реакцияға қатысатын заттардың тепе-теңдік концентрацияларын табуға болатынын көрсетеді. Әртүрлі заттардың алынуына сәйкес Гиббс стандартық энергиясының мәні термодинамикалық анықтамалықтарда келтірілген.
3.2. Идеалды және реалды жүйелер.
Массалар әрекеттесу заңына (3.1-3.2) сүйеніп қорытылып шығарылған тепе-теңдік константасының теңдігі (3.4) заттардың кез-келген концентрацияларына сәйкес деп есептелінеді. Бірақ, тәжірибеде (3.1), (3.2), (3.4) теңдіктері реакцияласатын заттардың өте төменгі концентрацияларына ғана әділетті, ал заттың жоғарғы концентрацияларында бұл заңдылықтар толық сақталмайды. Реагентредің концентрациялары өскен сайын жүйенің (3.1), (3.2), (3.4) теңдіктерінен ауытқуы артады. Реагенттердің концентрациялары өзгеруімен тепе-теңдік константасының мәні де өзгере бастайды, демек тепе-теңдік константасының тұрақтылығы сақталмайды.
Массалар әрекеттесу заңына толық бағынатын жүйелерді (ерітінділерді) идеалды жүйелер деп атайды. Бұл реагенттердің концентрациялары өте төмен жүйелер, ал ерітінділерде – шексіз сұйытылған ерітінділер.
Реалды ерітінділерде иондардың алғашқы концентрациялары осы иондардың шын химиялық активтігіне сәйкес келмейді, сондықтан олардың идеалды ерітінділерден айырмашылығы бар. Реалды жүйелерде әрекеттесетін бөлшектерге иондар мен молекулалардың әсер етуіне байланысты реакцияласатын заттардың концентрацияларынан олардың шындық химиялық активтігі төмен болады.
Реалды жүйелердегі реакцияласатын бөлшектердің идеалды жүйедегі бөлшектерден айырмашылығының бір себебі – электростатикалық ион-ион, ион-диполь, диполь-диполь әрекеттесулері. Иондардың өзара әсерлесу күші олардың химиялық әрекеттесу қабілеттігін азайтады. Сондықтан иондардың эффектілі концентрациясын ескеру үшін активтік концентрация (активтік α) деген ұғым енгізіледі:
α= f . c
f – активтік коэффициент, иондардың бір-біріне әсері мен бөлшектердің химиялық реакцияға қабілеттігінің арасындағы байланысты көрсетеді.
Идеалды жүйелерде f → 1, α ≈ с. Реалды жүйелерде активтік коэффициенттің бірден айырмашылығы болғандықтан алғашқы концентрацияға тең емес (α ≠ с).
Тепе-теңдік константасы теңдігіндегі концентрацияның орнына активтікті қойса К реагенттердің кез-келген концентрациясында өзінің тұрақтылығын сақтайды және термодинамикалық тепе-теңдік константасы деп аталады:
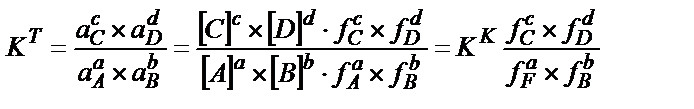 (3.6)
(3.6)
Құрамында тек аниондар (f –), не катиондар (f +) бар ерітінділерді дайындауға болмайтындықтан, электролиттің судағы ерітіндісінде иондардың активтік коэффициенті ерітіндіде жүрген барлық иондарға байланысты. Сондықтан тәжірибеде анықтайтын мән – орташа иондық активтік коэффициент f ±.
Құрамы АВ сәйкес электролитте 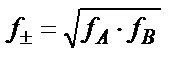 , не болмаса 2lg f ±=lg f A+lg f B. Құрамы АхВу сәйкес электролитте
, не болмаса 2lg f ±=lg f A+lg f B. Құрамы АхВу сәйкес электролитте 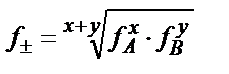 , (x+y)lg f ±=xlg f A+ylg f B.
, (x+y)lg f ±=xlg f A+ylg f B.
Шексіз сұйытылған электролиттің ерітіндісінде f ±→1, егер электролиттің концентрациясын арттырса ол f ± өзгеруіне әкеп соғады (3.1- сурет).
3.1-сурет f±-тің [HCl]-ға байланысы
|
3.1 суретінде келтірілгендей реалды ерітінділердің идеалды ерітінділерден ауытқуының екі түрі бар екен: І – теріс ауытқу f ±<1, ал α<c; ІІ–оң ауытқу f ±>1, ал α>c. Аналитикалық химияда электролиттердің сұйытылған ерітінділері пайдаланылатындықтан, аналитик 1.1 суреттегі қисықтың І – бөлігіне сәйкес жағдайда жұмыс істейді, яғни концентрация артқанда f ± бірден кемитін (f ±<1), ал активтік концентрациядан аз жағдайда (α<c).
3.3. Ерітіндінің иондық күші
Иондардың өзара әсері электростатикалық күшпен анықталатын электролиттердің ерітінділерінде жүйенің идеалдық жағдайынан ауытқуында иондардың жалпы концентрациясымен қатар олардың зарядының да үлесі бар. Концентрация мен зарядтың әсері ерітінділердің иондық күшімен сипатталады:
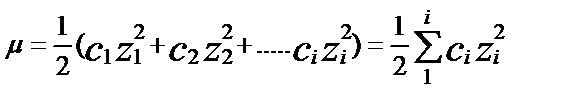 (3.7)
(3.7)
C i менZ i – белгілі і- ионыныңконцентрациясы мен заряды. Мысалы, құрамында 0,1М HCl және BaCl2 бар ерітіндінің иондық күші:
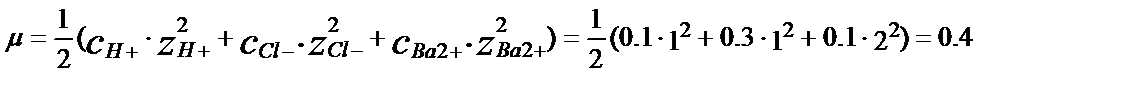
Ерітіндінің иондық күші мен активтік коэффициенттің арасындағы жалпы математикалық байланысты 1923 ж. Дебай мен Хюккель тапты:
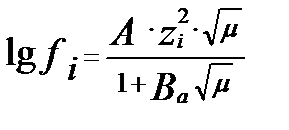
А- еріткіштің диэлектрикалық тұрақтылығы (D) мен абсолюттік температурадаға (Т) байланысты мән. 250С –да сұйытылған судағы ерітінді үшін А=0,512. В а – диэлектрикалық тұрақтылық және абсолюттік температурамен қатар бөлшектердің мөлшеріне байланысты. Ерітіндінің иондық күшіне (концентрациясына) қарай бұл байланыс әртүрлі теңдіктермен белгіленеді:
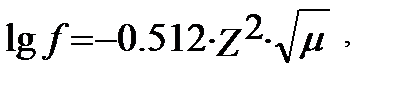 егер μ<10-2, С<0.01M (3.8)
егер μ<10-2, С<0.01M (3.8)
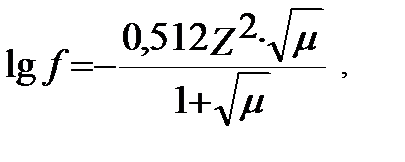 егер μ<10-1, С<0.1M (3.9)
егер μ<10-1, С<0.1M (3.9)
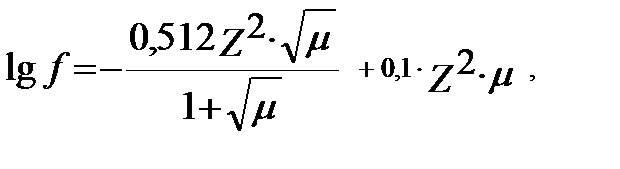 егер μ<1, С>0.1M (3.10)
егер μ<1, С>0.1M (3.10)
(Z – активтікгін анықтайтын ионның заряды).
(3.8), (3.9) теңдіктерін пайдаланып есептелген активтік коэффициенттердің мәні бірден кем және ерітіндінің иондық күші мен ионның заряды неғұрлым жоғары болса, бұл кему соғұрлым көп. Себебі, (3.8), (3.9) теңдіктерін пайдаланатын ерітінділерде тек электростатикалық байланыс орын алады: аттас иондар тебіседі, әр аттас иондар бір-біріне тартылады. Ерітінділердің концентрациялары артқан сайын ғана бөлшектердің арасында әрекеттесулер бола бастайды. Мысалы, иондардың аралық қашықтығы өте аз болғанда әр аттас иондар арасында да тебісу күші пайда болады, не ерітіндіде жаңа иондық жұптар түзіледі. Ерітіндінің иондық күшінің артуы еріткіштің (судың) қасиетіне де әсер етеді. Осының нәтижесінде (3.10) теңдігімен есептелген активтік коэффициенттің мәні бірден үлкен болуы да мүмкін. (Мысалы, 12М HCl-да орта иондық коэффициент f±=17.
Тәжрибеде иондық күші бірдей сұйытылған ерітінділерде бірдей зарядты иондардың активтік коэффициенттері жуық мәнмен бір-біріне тең (3.1 кесте).
3.1-кесте.
Ерітіндінің әртүрлі иондық күшіне сәйкес орташа активтік коэффициенттің мәні (Дебай-Хюккель теңдігін пайдаланып есептелінген)
| Ионның заряды | Иондық күш, μ | |||||
| 0,001 | 0,005 | 0,01 | 0,05 | 0,1 | 0,2 | |
| 0,97 | 0,93 | 0,90 | 0,81 | 0,76 | 0,70 | |
| 0,87 | 0,74 | 0,66 | 0,44 | 0,33 | 0,24 | |
| 0,73 | 0,51 | 0,39 | 0,15 | 0,08 | 0,04 | |
| 0,56 | 0,30 | 0,19 | 0,04 | 0,01 | 0,003 |
3.4. Ерітінді иондық күшінің тепе-теңдік
константасына әсері
Реалды жүйелерде иондардың өзара электростатикалық әрекеттесу күшімен қатар бөгде химиялық реакцияның жүруі мүмкін. Мысалы, Na2CO3 ерітіндісіндегі СО32- анионының концентрациясын анықтағанда сутегі ионының концентрациясына байланысты ерітіндіде мынадай бөлшектер жүретінін еске алу керек: H2CO3, HCO3-, CO32-. Егер әр бөлшектің концентрациясын [H2CO3], [HCO3-], [CO32-] деп белгілесек, онда құрамында СО32- бар бөлшектердің жалпы концентрациясы былай жазылады:
Сж=[CO32-]+[HCO3-]+[H2CO3] (3.11)
Бізге қажетті мән [CO32-] болғандықтан [HCO3-] пен [H2CO3 мәндерін көмірқышқылының әр бөлшекке сәйкес ионизациялану константасымен өрнектеу керек:
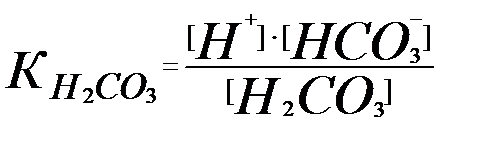
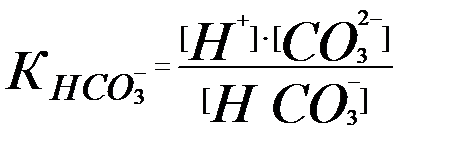
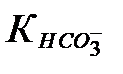 тің мәнінен
тің мәнінен 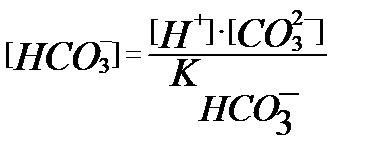 (3.12)
(3.12)
Көмір қышқылының жалпы ионизациялану константасы – Кж.
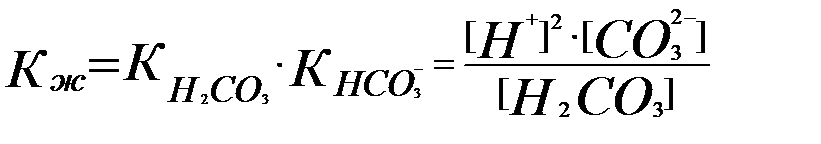
Бұл теңдіктен 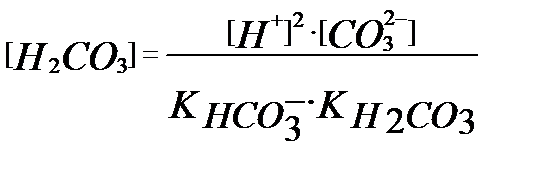 (3.13)
(3.13)
(3.12), (3.13) теңдіктерінен [НСО3-] пен [Н2СО3] мәндерін (3.11) теңдігіне қойсақ
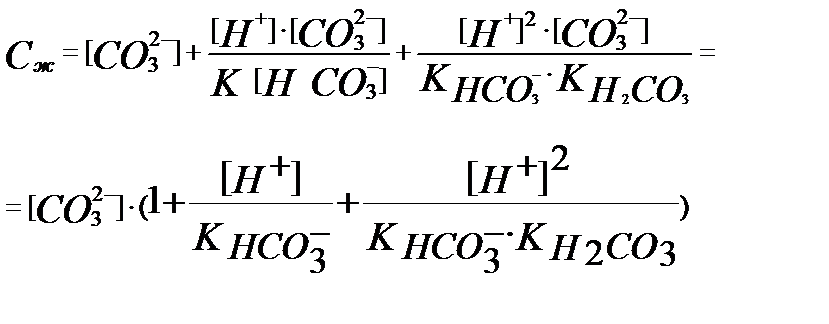
Бұдан 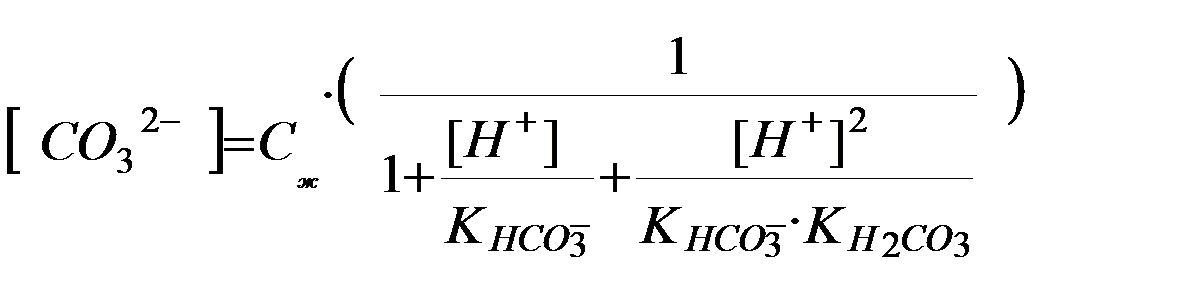 (3.14)
(3.14)
(3.14) теңдігіндегі жақша ішіндегі мән α – қосымша реакцияның коэффициенті, ол реакцияға қатысатын иондардың бос үлесін көрсетеді:
[CО32-] =Сж·α; α =[CO32-]/Cж; α <1
Егер тепе-теңдік константасының теңдігіне реакцияласатын заттардың жалпы концентрациясын қойсақ, шартты тепе-теңдік константасының (Кш) өрнегін аламыз:
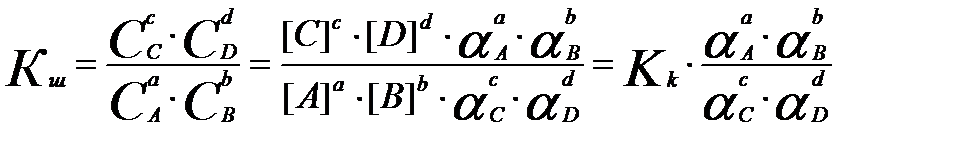 (3.15)
(3.15)
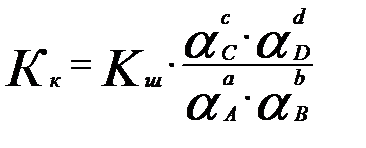
Жалпы алғандааА +вВ ↔ сС + dD реакциясы үш константамен сипатталады. Термодинамикалық не шындық тепе-теңдік константасы Кт ерітндінің иондық күшіне және бөгде реакциялардың жүруіне байланысты емес:
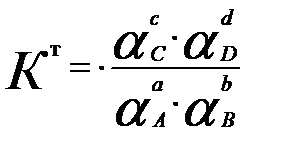
Бұл константа тек температура мен қысымға байланысты.
Ал концентрациялық константа Кк температура мен қысымнан басқа ерітнділердің иондық күшіне де тәелді. Кк және Кт константалары бір-бірімен былай байланысқан:
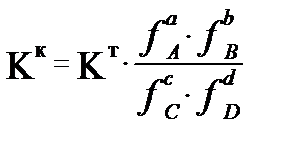 , не
, не
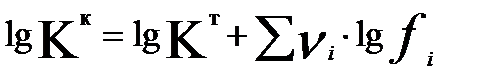 (3.16)
(3.16)
νі-стехиометриялық коэффициенттер.
(3.16) теңдігіне (3.8), (3.9), (3.10) теңдіктерінен lg f i мәндер қойсақ
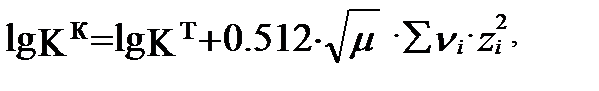 (3.17)
(3.17)
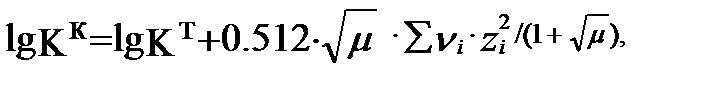 (3.18)
(3.18)
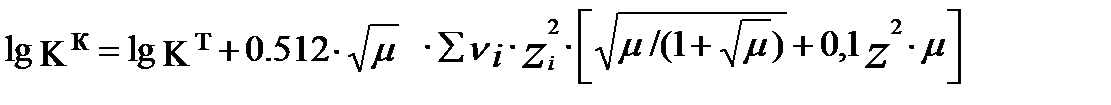 (3.19)
(3.19)
(3.17-3.19) теңдіктеріндегі концентрациялық тепе-теңдік константасы тек температура, тығыздық және ерітндінің иондық күші өзгермеген жағдайда ғана тұрақты мән.
Шартты тепе-теңдік константасы қысымға, температураға, ерітіндінің иондық күшіне және реакцияласатын бөлшектердің бөгде химиялық өзгеріске түсуіне байланысты.
Үш константалардың жалпы бір-бірімен байланысы:
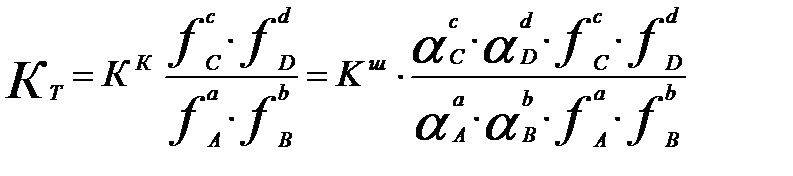 (3.20)
(3.20)
Ерекше көңіл аударатын жай активтілік коэффициент ерітіндіде жүрген бар иондардың электростатикалық әсерін, ал қосымша реакцияның коэффициентті иондарымен химиялық реакцияға түсетін, соған байланысты олардың ерітіндідегі концентрациясын азайтатын заттардың әсерін қамтып көрсетеді.
Ерітіндіде химиялық тепе-теңдіктердің сандық мәнін есептеу мынадай схема бойынша жүргізіледі:
1. Тепе-теңдікке қатысы бар реакцияның теңдігін жазу.
2. Әр химиялық реакцияға сәйкес тепе-теңдік константаларының теңдігін жазу. Жалғастырып анықтамаларды пайдаланып константалардың мәнін табу.
3. Заттың әр түрінің тепе-теңдік коцентрацияларының өзара және оның ерітіндідегі жалпы концентрациясын байланыстыратын жүйенің материалды баллансына сәйкес теңдігін жазу.
Мысалы, күміс нитратымен аммиактың судағы ерітіндісін алса, Ag+, [Ag(NH3)]+, [Ag(NH3)2]+ иондары түрінде жүруі мүмкін. Құрамында күміс бар бөлшектердің жалпы концентрациясы:
Сж = [Ag+]+[Ag(NH3) +] + [Ag(NH3) +2]
4. Электрбейтараптық теңдігін жазу. Кез-келген ерітіндіде катиондар мен аниондардың жалпы концентрациялары ерітіндіде электрбейтараптық сақтау үшін бір-біріне тең болу керек.
Мысалы, NaCl-дың судағы ерітіндісінде Na+ және Н3О+ катиондары, Cl- және ОН- аниондары жүреді. Ерітіндінің электрбейтараптық жағдайы:
[Na+ ]+[Н3О+] =[Cl-]+[ ОН-]
MgCl2 ерітіндісі үшін электрбейтараптық теңдігі былай жазылады:
2[Mg2+ ]+[Н3О+]=[Cl-]+[ОН-]
Магний ионының алдындағы коэффициент 2 сол ионның екі зарядты екенін ескеруге жазылған, себебі хлорид ионының концентрациясы магний ионының екі еселенген концентрациясына сәйкес. ([Cl-]=2[Mg2+ ]). Осы сияқты үш зарядталған иондардың концентарциясын үшке көбейту керек. Құрамында AI2 (SO4)3, MgCl2 бар ерітінділердің электрбейтараптық теңдігі:
[AI3+]+2[Mg2+ ]+[Н3О+] =2[SO2-4]+[НSO-4]+[Cl-]+[ОН-]
5. 2,3,4 бөлімдер бойынша жазылған теңдіктердегі белгісіз мәндердің санын тәуелсіз теңдіктердің санымен салыстыру. Егер белгісіз мәндер мен теңдіктердің саны тең болса, онда анықтайтын мәнді теңдіктерден алгебралық жолмен, яғни бірнеше теңдіктер жүйесін шешу арқылы табады. Егер теңдіктердің саны белгісіз мәндерден аз болса қосымша тәуелсіз теңдіктер жазылады.
Жиі есепті жеңілдету үшін кейбір жорамалдар жасалады. Жасалған жорамалдар нәтиженің дәлдігіне онша әсер етпеу керек.
Бақылау сұрақтары мен жаттығулар
1. Ерітіндідегі тепе-теңдікті қандай факторлар арқылы бұзуға болады?
2. Ерінтіндідегі заттың тепе-теңдік концентрациясы деп нені айтады?
3. Ерітіндідегі ионның активтік коэффициенті неге байланысты болады?
4. Дебай заңының теңдігіне қандай негізгі шамалар кіреді?
5. «Тұзды әсер» деген не, ол неге байланысты болады?
6. Концентрациялық және термодинамикалық тепе-теңдік константалар қандай факторларға байланысты болады?
7. Химиялық реакцияның жылдамдығы деген не және ол неге байланысты болады?
8. Химиялық реакцияның жылдамдығы немен сипатталады?
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 7335; Нарушение авторских прав?; Мы поможем в написании вашей работы!