
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые способы получения алканов
|
|
|
|
| Название реакции | Примеры |
| 1. Реакция Вюрца (лабораторный метод получения, главным образом, симметричных углеводородов) 2. Гидрирование угля 3. Гидрирование непредельных углеводородов 4. Сплавление солей карбоновых кислот со щёлочью 5. Восстановление галогенопроизводных насыщенных углеводородов | С2Н5 – I + 2Na + I – C2H5 →
→ C2H5 – C2H5 + 2NaI
nC + 2(n+1)H2 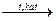 CnH2n+2
CH2=CH2 + H2 CnH2n+2
CH2=CH2 + H2 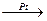 CH3 – CH3
СH3–COONa + NaOH CH3 – CH3
СH3–COONa + NaOH 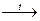 CH4 + Na2CO3
CH3 – I + HI → CH4 + I2 CH4 + Na2CO3
CH3 – I + HI → CH4 + I2
|
Предельные углеводороды характеризуются малой реакционной способностью, так как связи С – С и С – Н обладают высокой прочностью; кроме того, они малополярны и не склонны к гетеролитическому разрыву. Для них характерны гомолитические реакции замещения, т.е. реакции, протекающие по свободно-радикальному механизму.
Большинство из них является цепными и протекает в несколько стадий:
1) зарождение цепи (образование радикала):
Cl ÷ Cl → 2Cl∙
2) зарождение и перенос цепи:
│ │
- С ÷ Н + Сl∙ → - C ∙ + HCl
│ │
│ │
- C ∙ + Cl ÷ Cl → - C – Cl + Cl ∙
│ │
3) обрыв цепи:
Сl∙ + Cl∙ → Cl2
│ │ │
- C ∙ + - C ∙ → - C – C -
│ │ │
│ │
- C ∙ + Cl ∙ → - C – Cl
│ │
Атом углерода называется первичным, вторичным, третичным или четвертичным в зависимости от того, затратил ли он на связь с другими атомами углерода одну, две, три или четыре валентности. Согласно закономерностям, которые впервые установил В.В.Марковников, в реакциях замещения замена атома водорода на другие атомы или группы атомов легче всего происходит у третичного атома углерода, труднее - у вторичного и ещё труднее – у первичного.
Таблица 4
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!