
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Могилев, М. Е. 1 страница
|
|
|
|
ОБЩАЯ ХИМИЯ В КРАТКОМ ИЗЛОЖЕНИИ: ЗНАНИЯ И УМЕНИЯ
Книгоиздательская и книготорговая фирма
(812) 265-00-88 (812) 567-54-93
УВАЖАЕМЫЕ ЧИТАТЕЛИ!
Мы рады Вам сообщить, что с 1 января 1998 года в Издательстве “ЛАНЬ” начинает работу отдел “Книга — почтой”.
Для того, чтобы воспользоваться этой услугой и приобрести книги нашего издательства, Вам нужно заполнить почтовую карточку и отправить ее по нашему адресу:
193029, Санкт-Петербург, пр. Елизарова, д.1 (“ЛАНЬ”) Денисовой С. В.
Образец заполнения почтовой карточки:
Вы также можете оформить заказ с помощью электронной почты. E-mail:
root@lanpbl.spb.ru
lanpbl@nevsky.net
Издательство “ЛАНЬ”
V Книги нашего издательства V Обмен, в т.ч. междугородний, и закупку книг других издательств и книготорговых организаций V Приглашаем к сотрудничеству авторов и издательства для совместного выпуска книг V Формирование контейнеров в любую точку страны V Ответственное хранение по договорным
ценам V Экспедирование и перевозка книжной продукции Москва — Петербург, Петербург — Москва V Гибкая система скидок
ЖДЕМ ВАС ПО АДРЕСАМ:
РФ, Санкт-Петербург, пр. Елизарова, д. 1 Тел. (812) 567-54-93, 265-00-88, 233-88.27 Факс (812) 567-14-45
Филиал в Москве РФ, Москва, ул. Ташкентская, 34 к. 3
Тел. (095) 377-66-74
E-mail:
lanpbl@nevsky.net
root@lanpbl.spb.ru
По своей глубинной сущности культура есть развернутое во времени самоосуществление человека, его бытия.
Авторами проанализирована важная проблема философии культуры — исследование закономерностей превращения единой сущности культуры во множество конкретных культур, совершающееся в двух плоскостях — социальном пространстве и социальном времени.
Учебное пособие “Философия культуры” написано специалистами ведущих вузов Санкт-Петербурга и рекомендовано студентам, аспирантам и преподавателям гуманитарных специальностей.
Утверждено Редакционно-издательским советом университета в качестве учебного пособия
Санкт-Петербург
2011
УДК 546
ББК 24.1
М74
Рецензенты:
доктор химических наук, профессор ГОИ А. К. Яхкинд;
доктор химических наук, профессор СПбГУ В. А. Латышева
М74 Общая химия в кратком изложении: знания и умения: учеб.
пособие / М. Е. Могилев— СПб.: СПГУТД, 2011, — 89 с.
ISBN 978-5-7937-0354-3
На основе краткого изложения основ общей химии в пособии приводятся соответствующие этому изложению задачи и упражнения для усвоения знаний и выработки умений с предполагаемым последующим их контролем и самоконтролем.
Пособие предназначено для студентов заочной формы обучения, направление подготовки — бакалавриат.
УДК 546
ББК 24.1
ISBN 978-5-7937-0354-3
© СПГУТД, 2011.
© Могилев М. Е., 2011

Введение
Окружающий нас естественный (природный) или искусственно созданный мир представляет собой систему множества веществ и их превращений, с которыми человек постоянно сталкивается, являясь при этом одним из элементов этой системы. Вещества и их превращения — это химические вещества и химические реакции.
Вещества — кислород, вода, поваренная соль, углекислый газ, метан, аммиак, спирт, глюкоза и т. д.
Химические реакции происходят всюду: дыхание связано с окислительно-восстановительными реакциями при участии кислорода воздуха; горение метана, т. е. — реакция с кислородом, происходит при сжигании бытового газа, что приводит к образованию углекислого газа и воды с выделением огромного количества тепла; растворение в воде спирта, соли и других веществ — в значительной степени — тоже химические реакции. В человеческом организме непрерывно происходят последовательные и параллельные взаимосвязанные биохимические превращения, обеспечивающие жизнь человека.
Напрашивается вывод о том, что знание химии, хотя бы на уровне представлений и элементарных знаний и умений, необходимо любому интеллигентному человеку, независимо от характера его деятельности: и естественнику, и технику, и экономисту, и гуманитарию, и политику. Особенно это важно в наше время, когда на первое место выдвигаются проблемы экологии, энергопотребления, естественных и искусственных материалов, здоровья человека, государственной внутренней и внешней политики. Как тут не обойтись без понимания того, что такое воздух, вода, газ, нефть, уголь, лес, одежда, еда, лекарства, мусор, загрязнение, очистка и т.д.
Пособие предназначено для усвоения студентами некоторого ряда основных химических знаний в их кратком изложении и приобретения соответствующих умений с их последующим контролем. Предлагаемые задания в виде билетов относятся ко всему курсу общей химии и ее неорганической части.
Пособие предназначено для студентов-нехимиков заочной формы обучения.
Глава 1. Классификация неорганических соединений
Классификация неорганических веществ строится, прежде всего, на отношении простых веществ и их соединений к кислороду и воде.
Отношение к кислороду выражается в существовании оксидов. Оксиды — вещества, состоящие из атомов двух химических элементов, один из которых — кислород.
Примеры молекулярных и структурных формул оксидов
Na2O CO2 N2O3
 |
Продукты прямого или косвенного взаимодействия оксидов с водой являются либо основаниями, либо кислотами, либо веществами, способными проявлять как свойства оснований, так и свойства кислот (амфотерные гидрокисиды).
Примеры оснований
NaOH Ca(OH)2 Fe(OH)3
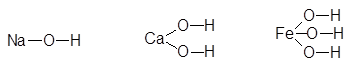 |
Примеры кислот
HCl HNO3 H2SO4
 |
Примеры амфотерных гидроксидов
Zn(OH)2 Al(OH)3 Sn(OH)2
 |
В общем виде основание и кислоту (кислородосодержащую) можно отличить по наиболее часто встречающемуся месту разрыва химической связи в химической реакции.
 |
Пример реакции нейтрализации
2NaOH + H2SO4 = Na2SO4 + 2H2O
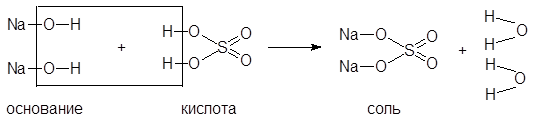 |
Реакции с участием амфотерного гидроксида
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
 |
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
 |
 Соль можно представить как продукт сочетания двух остатков: остатка основания и остатка кислоты. В соли Na2SO4
Соль можно представить как продукт сочетания двух остатков: остатка основания и остатка кислоты. В соли Na2SO4
остаток основания:
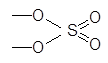 |
остаток кислоты
их сочетание приводит к написанной выше формуле.
 |
По количеству гидроксильных групп “ОН” в основании различают одно-, двух-, трех- и т. д. кислотные основания:
NaOH — однокислотное основание;
Ca(OH)2 — двухкислотное основание;
Fe(OH)3 — трехкислотное основание.
По количеству способных замещаться атомов водорода кислоты подразделяются на одно-, двух-, трех- и т. д. основные кислоты:
HNO3 — одноосновная кислота;
H2SO4 — двухосновная кислота;
H3PO4 — трехосновная кислота.
CH3COOH — одноосновная кислота, так как из 4-х атомов водорода значительно легче других замещается один атом водорода:
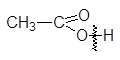 |
В солях могут содержаться не полностью замещенные остатки оснований и кислот. Такие соли, в отличие от средних, называются соответственно основными и кислыми.
Пример
Пусть следует составить всевозможные соли гидроксида магния и угольной кислоты.
Формулы основания и кислоты:
Mg(OH)2 H2CO3
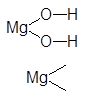 | 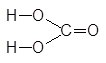 | ||
Средняя соль
Остаток основания:
 |
Остаток кислоты:
При соединении этих остатков получим
 |
Основная соль
 |
Остаток основания
 |
Остаток кислоты
 Их сочетание
Их сочетание
В основной соли содержатся незамещенные группы “ОН”. Однокислотные основания основных солей не образуют.
 Кислая соль
Кислая соль
Остаток основания
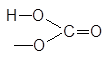 |
Остаток кислоты
 |
Их сочетание
В кислой соли содержатся незамещенные атомы водорода кислоты. Одноосновные кислоты кислых солей не образуют.
Названия рассмотренных классов соединений
(наиболее употребительные)
Оксиды
Na2O — оксид натрия (I),
FeO — оксид железа (II),
Fe2O3 — оксид железа (III),
CO2 — оксид углерода (IV).
В скобках указаны валентности химических элементов, соединенных с кислородом.
Не следует пренебрегать и другими, часто тривиальными названиями. Так, последний оксид чаще всего называют “углекислым газом”, или “двуокисью углерода”.
Основания
NaOH — гидроксид натрия (I),
Fe(OH)2 — гидроксид железа (II),
Fe(OH)3 — гидроксид железа (III).
Кислоты
HNO3 — азотная кислота,
HNO2 — азотистая кислота,
H2SO4 — серная кислота,
H2SO3 — сернистая кислота.
С названием кислот несколько сложнее. Их следует выучить, подметив при этом некоторые закономерности.
Еще примеры названий кислот:
HCl — хлороводородная кислота,
HClO — хлорноватистая кислота,
HClO2 — хлористая кислота,
HClO3 — хлорноватая кислота,
НClO4 — хлорная кислота.
Соли
Наиболее принято давать названия с указанием на 1-м месте названия остатка кислоты в именительном падеже.
Соли приведенных выше кислот называются:
нитрат (от HNO3), нитрит (от HNO2), сульфат (от H2SO4), сульфит (от H2SO3), хлорид (от HCl), гипохлорит (от HClO), хлорит (от HClO2), хлорат (от HClO3) перхлорат (от НClO4).
И, наконец, назовем приведенные ранее соли:
Na2SO4 — сульфат натрия,
ZnSO4 — сульфат цинка,
Na2ZnO2 — цинкат натрия,
MgCO3 — карбонат магния,
(MgOH)2CO3 — карбонат гидроксомагния,
Mg(HCO3)2 — гидрокарбонат магния.
Приставка “гидроксо” указывает на наличие незамещенной гидроксильной группы основания Mg(OH)2.
Приставка “гидро” говорит о содержании в кислой соли незамещенного атома водорода кислоты H2CO3.
Если в соли окажутся незамещенные две и более ОН-группы или два или более атома водорода, то в названии солей появятся приставки: “ди”, “три” и т. д.
Примеры
Al(OH)2NO3 — нитрат дигидроксоалюминия,
KH2PO4 — дигидрофосфат калия.
Глава 2. Атомно-молекулярная теория
Атомы и молекулы
Мельчайшими химически неделимыми частицами являются атомы. В результате химических реакций разделить атом на его составные части: протоны и нейтроны (это частицы ядра атома), и электроны, — не удается. Атомы, объединяясь друг с другом, очень часто образуют молекулы.
Множество атомов, имеющих одно и то же количество протонов в ядре, называются химическим элементом. Так как каждый протон имеет один положительный заряд (р+), то количество протонов в ядре атома равно заряду ядра атома, который компенсируется в атоме отрицательными зарядами электронов (е-), располагающихся вокруг ядра. Поэтому можно сказать, что принадлежность атома определенному химическому элементу зависит от заряда ядра атома.
Каждому химическому элементу отвечает определенное только ему принадлежащее место в Периодической системе Д. И. Менделеева. Номер клеточки химического элемента в Периодической таблице численно равен количеству протонов в ядре атома, а также заряду ядра.
Так, все атомы водорода (Н) имеют в своем составе по одному протону; заряд ядра их атомов +1 и в Периодической таблице они занимают место № 1. Два протона имеют атомы гелия (Не) и его место — № 2; три протона имеют атомы лития (Li) и его место — № 3; двадцать протонов — атомы кальция и его место — № 20, и это справедливо для любого химического элемента.
Для одного и того же химического элемента возможно существование разных по массе (массовому числу) атомов, отличающихся друг от друга неодинаковым количеством нейтронов, которые не влияют на заряд ядра, но определяют его массу наряду с протонами, имеющими с нейтроном практически одинаковую массу.
Сумму количества протонов и нейтронов в ядре называют массовым числом, которое с незначительной ошибкой определяет массу атома, так как масса электрона примерно в 1840 раз меньше массы нуклона. Нуклон — это частица ядра: либо протон, либо нейтрон.
Атомы одного и того же химического элемента, отличающиеся друг от друга по массе (массовому числу), называются изотопами.
Пример
Химический элемент хлор имеет 3 изотопа:
35 36 37
Cl Cl Cl
17 17 17
Слева внизу указан порядковый номер в Периодической таблице, слева вверху — массовое число. Стабильными изотопами среди них являются первый и третий.
Состав этих изотопов:
35
Cl: 17 протонов; 18 нейтронов; 17 электронов;
17
36
Cl: 17 протонов; 19 нейтронов; 17 электронов;
17
37
Cl: 17 протонов; 20 нейтронов; 17 электронов.
17
Массы атомов и молекул. Атомная масса
Массы атомов измеряются в единицах, называемых атомными единицами массы (а.е.м.), или углеродными единицами (у.е.). Атомная единица массы – это 1/12 часть массы изотопа углерода с массовым числом 12.
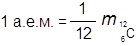 |
Понятия “атомная масса” и “масса атома” — похожие понятия, но не тождественные. Масса атома — это масса конкретного изотопа, а атомная масса — усредненное понятие, учитывающее, в частности, распространенность различных атомов — изотопов в природе.
Так, в природе существуют два изотопа хлора: 35Cl и 37Cl. Однако атомная масса хлора не 35 и не 37, а 35,5 а.е.м., так как содержание изотопов хлора в природе: 35Cl — 75,4 % и 37Cl — 24,6 %. Средняя величина 35,5 а.е.м.(А).
А = 35 · 0,754 + 37 · 0,246 = 35,49 а.е.м.
 Принято атомные массы химических элементов указывать в клеточках Периодической таблицы Д. И. Менделеева наряду с символом химического элемента, его номером и названием.
Принято атомные массы химических элементов указывать в клеточках Периодической таблицы Д. И. Менделеева наряду с символом химического элемента, его номером и названием.
Количество вещества
Массы атомов на атомно-молекулярном уровне (микроуровне) обычно измеряются в а.е.м. и в относительно небольшом числе атомов и молекул.
Для выражения количества вещества на макроуровне используется единица измерения, называемая моль, — а массу моля называют молярной (мольной) массой, которую выражают в граммах. Единица количества вещества моль признается Международной системой СИ.
Понятие моль можно определить следующим образом. Это такое количества вещества, которое содержит 6,02·1023 частиц. В принципе — любых частиц: молекул, атомов, ионов, радикалов или др. Число 6,02·1023 называется числом Авогадро. Так как молярная масса – масса одного моля, выраженная в граммах, то размерность молярной массы [г/моль].
Размерность атомной и молекулярной массы:
[а.е.м./атом] и [а.е.м./молекула].
Масса 1а.е.м., выраженная в граммах, равна
 |
В атомных единицах массы выражаются как массы атомов, так и молекул. Тогда на этом уровне масса молекулы называется молекулярной массой (μ).
Численно атомные и молекулярные массы, выраженные в а.е.м.,равны молярным массам, выраженным в г/моль.
Примеры
N2: μ = 28 а.е.м.; М = 28 г/моль,
H2O: μ = 18 а.е.м.; М = 18 г/моль,
H2SO4: μ = 2+ 32 + 64 = 98 а. е. м.; М = 98 г/моль,
где μ — молекулярная масса (сумма атомных масс химических элементов);
М — молярная масса.
Чтобы понять огромное смысловое различие между атомно-молекулярным и молярным количеством вещества приведем такие примеры.
Примеры
Вычислить массу одной молекулы углекислого газа, а также одной молекулы кислорода и одной молекулы воды — в граммах.
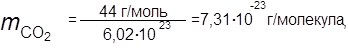 |
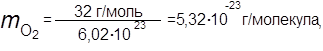 | ||
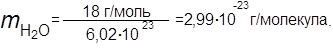 |
Газовые законы
Можно сказать, что из трех агрегатных состояний – твердого, жидкого и газообразного – наиболее легко поддается изучению газообразное состояние, которое предполагает практическое отсутствие взаимодействия между молекулами газа. При описании свойств газов используют газовые законы идеального газа: закон Авогадро, закон Бойля-Мариотта и Гей-Люссака, уравнение Менделеева-Клапейрона, закон Дальтона о давлении смеси газов. Газы, находящиеся при обычных условиях, не так сильно отличаются от идеальных газов, поэтому к ним могут быть применимы указанные выше законы.
Закон Авогадро
Для выполнения многих заданий, представленных ниже, необходимо понимание смысла закона Авогадро и его следствий.
Так как, согласно закону Авогадро, в равных объемах любых газов при одинаковых условиях(одинаковой температуре и одинаковом давлении) содержится одно и тоже количество молекул, то молярные объемы — объемы одного моля любых газов — одинаковы при одинаковых условиях и, в частности, при нормальных условиях молярный объем всякого газа равен 22,4 л.
Нормальные условия – температура 0оC (273К) и давление 1,013·105 Па (101,3 кПа; или 1 атм; или 760 мм рт. ст.)
Закон Авогадро требует конкретизации состава молекул. Так, молекулы многих простых веществ двухатомны: H2; O2; F2; Cl2…Молекулы инертных газов одноатомны: He; Ne; Ar…Молекула озона трехатомна: O3; молекулы серы — восьмиатомны: S8, а при повышении температуры газообразной серы ее атомность уменьшается: S6; S4; S2; S и т. д.
В одном моле вещества независимо от агрегатного состояния содержится число Авогадро молекул (6,02·1023).
Плотность одного газа по другому равна отношению их молекулярных (молярных) масс.
D½ — плотность первого газа по второму,
D½ = μ1/ μ 2 или D½ = M1/M2.
 Например, плотность по водороду или по воздуху можно выразить следующим образом:
Например, плотность по водороду или по воздуху можно выразить следующим образом:
2 а.е.м. – молекулярная масса водорода.
29 а.е.м. – средняя молекулярная масса воздуха.
Зная плотность данного газа по водороду, воздуху или по другому газу, можно вычислить искомые молекулярные (молярные) массы веществ — μ или М.
В химических реакциях газы взаимодействуют друг с другом так, что их объемы, а также объемы получающихся газов относятся друг к другу как небольшие целые числа при одинаковых условиях. Эти числа — это коэффициенты перед формулами веществ в уравнении химической реакции.
Примеры
N2 + 3H2 = 2NH3 N2 + O2 = 2NO
Отношения объемов газов в этих двух реакциях соответственно равны:
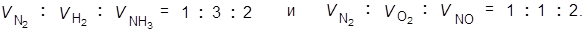 |
Данное следствие называется законом объемных отношений Гей-Люссака.
Закон Дальтона о том, что давление смеси газов является суммой парциальных (“частичных”) давлений газов, входящих в смесь, также можно считать следствием из закона Авогадро, если представить себе, что давление газа при постоянной температуре пропорционально числу молекул в определенном объеме (т. е. концентрации газов). В связи с этим можно сказать, что давление определяется числом ударов молекул в единицу времени о единицу поверхности.
Уравнение Менделеева—Клапейрона
Уравнение Менделеева—Клапейрона является объединением законов Бойля—Мариотта и Гей-Люссака(закона термического расширения газов) и Шарля.
pV = nRT;
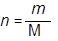 |  | ||
где p – давление газа;
V — объем газа;
n — число молей газа;
T — абсолютная температура газа;
m — масса газа;
M — молярная масса газа;
R — универсальная газовая постоянная.
При применении данного уравнения важно правильно и согласованно использовать единицы измерения всех параметров и, в частности, универсальной газовой постоянной (R), которая может иметь разные численные значения в зависимости от применения разных единиц измерения.
Так, в системе СИ:
R = 8,31 Па · м3/(моль · К) = 8,31 Дж/(моль · К).
Другие примеры значений R:
R = 8,31 кПа · л/(моль · К); R = 0,082 атм·л/(моль · К);
R = 62,4 мм рт.ст. · л/(моль · К).
Пример
Вычислить молекулярную массу газа, если известно, что 0,644 г газа занимают объем 500 мл при t = 30 ° C и давлении в 2 атм.
Решение
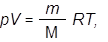 |  | ||
Приведем 3 варианта решений.
R = 8,31 Дж/(моль·К).
Тогда
m = 0,644 г; T = 30 + 273 = 303 К,
p = 2 · 1,013 · 105 = 2,026 · 105 Па,
V = 0,5 · 10-3 м3
M = 0,644 · 8,31 · 303/(2,026 · 105 · 0,5 · 10-3) = 16,0 г/моль,
R = 0,082 атм·л /(моль·К).
Тогда
M= 0,644 · 0,082 · 303 /(2 · 0,5) = 16,0 г/моль,
R = 62,4 мм.рт.ст.·л/(моль·К),
M = 0,644 · 62,4 · 303 /(2 · 760 · 0,5) = 16,0 г/моль.
Расчет процентного состава и вывод химических формул веществ
Рассмотрим эти расчеты на примерах.
1. Рассчитаем процентный состав химических элементов по массе в карбонате натрия Na2CO3.
Молекулярная масса вещества является суммой атомных масс химических элементов.
µ = 2 · 23 + 12 + 3 · 16 = 106 а. е. м.
М = 106 г/моль.
 Вполне понятно, что процентное содержание каждого элемента оказывается равным
Вполне понятно, что процентное содержание каждого элемента оказывается равным
2. Выведем химическую формулу вещества, имеющего в своем составе 40,0 % углерода, 6,67 % водорода и 53,3 % кислорода по массе. Известно, что плотность паров этого вещества по воздуху 2,07.
Решим задачу двумя способами.
1. Пусть мы имеем 100 г вещества. Узнаем количество молей атомов каждого из элементов, входящих в вещество, что численно равняется числу атомов этих элементов в молекуле.
Получим соотношения:
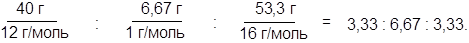 |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 888; Нарушение авторских прав?; Мы поможем в написании вашей работы!