
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Могилев, М. Е. 2 страница
|
|
|
|
Количество атомов, как правило, не предполагает дробное число. Поэтому полученные числа разделим на наименьшее из них и получим
1: 2: 1
Получилась формула вещества СН2О
Ее называют простейшей. Она может и не быть истинной формулой. Чтобы узнать, является ли она истинной, сравним сумму атомных масс простейшей формулы с истинной величиной молекулярной массы, т. е. определим n в формуле (СН2О) n.
Так как плотность по воздуху 2,07, то молекулярная масса вещества, исходя из следствия из закона Авогадро, равна
µ = 29 · 2,07 = 60 а. е. м.
Сумма атомных масс в простейшей формуле
12 + 2 + 16 = 30 а. е. м.
 Отсуда получаем n:
Отсуда получаем n:
Итак, истинная формула вещества (СН2О)2, или С2Н4О2.
2. Так же определим молекулярную массу вещества:
µ = 29 · 2,07 = 60 а. е. м.
Затем определим содержание каждого химического элемента в а. е. м. (m c; m н; m o), зная их содержание, выраженное в процентах:
m c = 60 · 0,400 = 24 а. е. м.,
m н = 60 · 0,0667 = 4 а. е. м.,
m o = 60 · 0,533 = 32 а. е. м.
 И, наконец, зная атомные массы химических элементов, входящих в вещество, получим количества атомов каждого химического элемента в молекуле вещества: n с; n н; n о.
И, наконец, зная атомные массы химических элементов, входящих в вещество, получим количества атомов каждого химического элемента в молекуле вещества: n с; n н; n о.
Сразу получаем истинную формулу С2Н4О2.
Такую формулу имеет уксусная кислота СН3СООН.
Глава 3. Строение атома. Химическая связь
Электронные конфигурации атомов химических элементов
В химических реакциях происходит изменение электронной оболочки атомов. Поэтому важным является знание и понимание состояний электронов в атоме, которые описываются четырьмя квантовыми числами. Согласно принципу Паули, в атоме не может быть двух или более электронов с одинаковым набором квантовых чисел.
Первое квантовое число, называемое главным квантовым числом и обозначаемое n, — указывает на запас энергии атома, когда электрон находится в данном электронном слое. Упрощенно можно сказать и так — на запас энергии электронов, находящихся на данном, основном энергетическом уровне. Короче говоря, главное квантовое число является номером электронного слоя, в котором находится электрон, имеющий при этом характерную для данного слоя энергию.
Главное квантовое число может иметь целочисленные значения:
n = 1, 2, 3, 4……..∞
n = 1 — имеет электрон первого слоя;
n = 2 — имеет электрон второго слоя;
n = 3 — третьего и т. д.
n = ∞ — подразумевается ионизация: полный отрыв электрона от атома.
Второе квантовое число указывает на некоторое энергетическое различие электронов одного и того же электронного слоя. Оно может принимать значения:
l = 0, 1, 2, 3….(n = -1), где n — главное квантовое число.
Например, во втором электронном слое (n = 2) имеются электроны со значениями l = 0 и 1.
Вместо численных значений второму квантовому числу приписываются буквенные обозначения:
l = 0 — s; l = 1 — p; l = 2 — d; l = 3 — f.
s, p, d и f —электронам соответствуют различные формы электронного облака (“орбитали”).
s — электронам отвечает шаровая форма:
 |
р — электронам отвечает гантелеобразная форма:
 |
d и f — электронам — непростое сочетание гантелеобразных форм.
Третье квантовое число ml связано с пространственной ориентацией электронных облаков и может иметь целые значения, зависящие от l.
m l = + l…0…- l.
Так, для р-электронов (l = 1) ml может иметь 3 значения:
m l = + 1; 0; - 1.
Для d-электронов (l = 2):
m l = +2; +1; 0; -1; -2 и т. д.
Часто третье квантовое число называют “магнитным квантовым числом”.
Четвертое квантовое число определяет собственный момент количества движения электрона в виде двух чисел: +½ и –½. Называют его спиновым квантовым числом, или просто “спином”.
Его обозначают m S.
m s = +½ или –½.
Одной электронной орбитали, описываемой тремя квантовыми числами (n, l и m l) отвечает наличие либо двух электронов с противоположными спинами +½ и –½; либо одного электрона; либо отсутствие электронов с возможностью их появления.
Изобразив электронную орбиталь квадратиком, названным электронной или квантовой ячейкой, получим варианты:
|
| ||||
 | |||||
Каждая орбиталь определяется первым, вторым и третьим квантовыми числами n, l и m l, а в целом состояние электрона в атоме характеризуется сочетанием всех четырех квантовых чисел:
n; l; m l и m S.
Электронов в данном атоме, имеющих полностью одинаковые сочетания четырех квантовых чисел, не существует.
В соответствии со сказанным приводим таблицу распределения электронов по различным электронным слоям атома (табл. 1).
В табл.1 указаны значения четырех квантовых чисел n; l; m l и m S, а также:
N 2 — максимальное число электронов с одним и тем же значением второго квантового числа l;
N 1 — максимальное число электронов с одним и тем же значением главного квантового числа n, т. е. максимальное количество электронов в данном слое.
Таблица 1. Распределение электронов в атоме
| n | l | ml | mS | N2 | N1 |
| s (0) s (0) | +½ -1/2 | ||||
| s (0) s (0) | +1/2 -1/2 | ||||
| p (1) p (1) p (1) p (1) p (1) p (1) | +1 +1 -1 -1 | +1/2 -1/2 +1/2 -1/2 +1/2 -1/2 | |||
| …и т. д. |
В первом слое (n = 1) максимально возможное количество электронов — 2; во втором — 8 (2 электрона s и 6 электронов p).
Продолжая эту таблицу, получим максимально возможное число d -электронов — 10, начиная с третьего слоя, и f -электронов — 14, начиная с четвертого электронного слоя.
Итак, в одном электронном слое может быть не более двух (n = 1); восьми (n = 2); восемнадцати (n = 3); тридцати двух (n = 4) – электронов.
N 1 = 2 n 2.
В пределах одного электронного слоя электроны, несколько отличающиеся по энергии от основного энергетического уровня, соответствуют подуровням, т. е. — l. Максимальное число электронов в подслоях, на подуровнях равно: s — 2; p — 6; d — 10; f — 14,что записывают так:
s 2; p 6; d 10; f 14
В показателе степени — число электронов с данным 1.
При составлении электронных конфигураций (“электронных формул”) атомов химических элементов указывается сначала номер слоя (n), в котором содержатся электроны, а затем значения 1 в виде букв (s, p, d или f) и число электронов в показателе степени.
Например
2 p 3 – означает то, что во втором электроном слое содержится 3 p -электрона.
3 d 5 – в третьем электронном слое находится 5 d -электронов.
3 s 23 p 6 – в третьем электронном слое:
2 s- электрона и 6 p -электронов.
Перед составлением электронных конфигураций атомов химических элементов используем следующие предпосылки.
В атоме происходит заполнение электронных орбиталей в соответствии с принципом минимума энергии. Сначала заполняются орбитали слоев, наиболее близко расположенных к ядру атома и наиболее сильно с ним энергетически связанных.
Общую схему заполнения орбиталей в случае запаздывания d - и f -электронов можно представить следующим образом:
ns 2 → (n-1) d 1 → (n -2) f 1-14 → (n - 1) d 2-10 → np 6 → (n + 1) s 2 → и т. д.
Распределение электронов в атомах химических элементов находится в полном согласии с Периодическим законом Д. И. Менделеева.
Ниже приведем примеры составления электронных конфигураций, соответствующих разным химическим элементам.
Н: 1 s 1. В атоме водорода в первом эектронном слое (первая цифра) находится один электрон (цифра 1 в показателе степени).
Каждый следующий элемент в Периодической системе имеет на один протон больше и, следовательно, и на один электрон больше.
Не: 1 s 2. В атоме гелия в первом слое два s -электрона.
Li: 1 s 22 s 1. В первом слое более двух электронов находиться не может. Поэтому “новый” электрон оказывается во втором слое.
Далее:
Ве: 1 s 22 s 2; В: 1 s 22 s 22 р 1 …….. Nе: 1 s 22 s 22 р 6.
В атомах элементов от В по Nе включительно идет появление р -электронов от одного до шести включительно, так как максимально возможное число р -электронов в одном слое — 6: р 6.
Еще два примера
 |


 26Fе: 1 s 22 s 22 р 63 s 23 р 63 d 64 s 2
26Fе: 1 s 22 s 22 р 63 s 23 р 63 d 64 s 2
64Gd: 1 s 22 s 22 р 63 s 23 р 63 d 104 s 24 р 64 d 104 f 75 s 25 р 65 d 16 s 2
Часто распределение электронов в атоме дается по квантовым ячейкам, соответствующим электронным орбиталям, о чем говорилось выше (с. 19). При этом учитывается правило Гунда о таком распределении электронов по ячейкам с данным значением l, чтобы суммарный спин атома был бы максимален, или, что то же самое, было бы заполнено возможно большее число ячеек.
Примеры
1. N: 1 s 22 s 22 р 3. Возможны такие варианты:
 |
Суммарный спин в первом случае:
0 + 0 + ½ + ½ + ½ = 3/2;
во втором случае:
0 + 0 + 0 + ½ = ½.
Выше были описаны методы составления электронных конфигураций для основных, невозбужденных состояний атомов. Но возможны и возбужденные состояния, предполагающие повышение значений как главного, так и второго квантового числа (n и l) — вплоть до ∞. В частности, ∞ предполагает полный отрыв электрона от атома, его ионизацию, что сопровождается затратой энергии — энергии ионизации.
Основные три типа химической связи
Наличие электронов в атомах приводит к возможности соединения атомов друг с другом с помощью химических связей, простейшие представления о которых основаны на образовании электронных пар.
Образовавшиеся электронные пары (молекулярные орбитали) могут давольно часто быть смещенными в сторону одного из соединяющихся атомов. Способность атома в химической связи присоединять к себе электронную пару определяется величиной его электроотрицательности. Самое высокое значение электроотрицательности имеет фтор (в относительных единицах — 4,0), затем — кислород (3,5). Металлы имеют невысокие значения электроотрицательностей.
Примеры
Электроотрицательности химических элементов второго периода Периодической системы соответственно равны:
Li — 1,0; Ве — 1,5; В — 2,0; С — 2,5; N — 3,1; О — 3,5; F — 4,0.
Изобразив электроны химической связи точками, приведем схемы химических связей между атомами А и В при разных случаях смещения электронных пар. Через Х обозначим электроотрицательность.
| А:В | А:В | А:В |
| Х А = Х В | Х А < Х В | Х А << Х В |
    
| ||
| Ковалентная неполярная связь | Ковалентная полярная связь | Ионная связь |
В случае ковалентной неполярной связи смещение электронов в сторону одного из атомов отсутствует. Связь называется ковалентной, так как происходит совместное владение электронной парой обоими атомами, а неполярной — из-за отсутствия появления зарядов в частях молекулы: центры положительного и отрицательного зарядов совпадают.
 |
Примеры
Связь в молекулах простых веществ: Н2, N2, О2. Близки к этому химические связи в органических соединениях между атомами углерода:
—С—С—
В случае ковалентной полярной связи атомы владеют электронной парой также совместно, но при этом электронная пара смещается в сторону атома более электроотрицательного химического элемента.

Это наиболее распространенный тип химической связи.
Примеры
HCl H2O NH3 и т. д.
Ионная связь образуется при соединении атомов химических элементов с сильно выраженными противоположными химическими свойствами, с большой разностью электроотрицательностей. При очень сильном смещении электронов образуются противоположно заряженные ионы; поэтому этот тип связи и называют ионной.
 |
Примеры
NaCl KBr NaI
Отметим еще один тип химической связи, отличающийся от рассмотренных типов тем, что оба электрона (пара электронов) до образования связи между атомами принадлежат одному атому. Другой атом при этом имеет свободную орбиталь. Схематически изобразим это следующим образом:
А׃ + □В ® А ׃ В
Такая связь называется донорно-акцепторной; атом, дающий электронную пару (А), называется донором, а атом, принимающий электронную пару (В), — акцептором.
В качестве примера приведем случай образования донорно-акцепторной связи в реакции взаимодействия аммиака с хлористым водородом.
NH3 + HCl = NH4Cl
Атом азота аммиака образует с ионом водорода донорно-акцепторную связь.
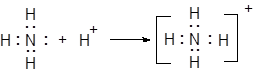 |
Атом азота — донор, ион водорода — акцептор.
Донороно-акцепторная связь чрезвычайно распространена, в частности, в комплексных соединениях (см. гл. 10).
Очень часто прибегают к чрезвычайно полезной формализации представления о химической связи и о валентности путем введения понятия «степень окисления».
Степенью окисления данного химического элемента называется условный заряд атома в химической связи при предположении, что химическая связь является ионной.
При использовании и вычислении степеней окисления полезно иметь ввиду следующее.
1. Степень окисления элементов в соединении с ковалентной неполярной связью равна нулю: отсутствует смещение электронов.
Примеры
Простые вещества —
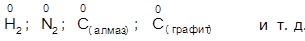
2. В случае ионной связи степень окисления равна зарядам ионов:
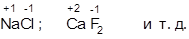
3. В соединениях с ковалентной полярной связь предполагается мысленное превращение ее в ионную. И атомам приписываются те величины зарядов, которые они имели бы, если бы стали ионами.
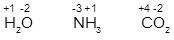
4. Как видно из написания приведенных примеров, степень окисления принято записывать арабскими цифрами над символами химических элементов с указанием знака перед числом.

5. Отрицательное число обычно приписывается атому более электроотрицательного химического элемента.
Электроотрицательность — свойство атома, характеризующее его способностью в химической связи притягивать к себе электронную пару. Обычно выражают электроотрицательность химических элементов в относительных единицах.
Ниже приводятся значения электроотрицательностей химических элементов двух периодов периодической системы, включая водород.
| Н 2,1 | ||||||
| Li 1,0 | Ве 1,5 | В 2,0 | С 2,5 | N 3,0 | О 3,5 | F 4,0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | Р 2,1 | S 2,5 | Cl 3,0 |
Пример:
Чему равна степень окисления серы в серной (H2SO4) и сернистой (H2SO3) кислотах?
Известно: степени окисления водорода (+1) и кислорода (-2)

Степень окисления серы обозначим через х. Тогда х вычисляется по уравнению
(+1)2 + х + (-2)4 = 0 х = +6
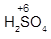
(+1)2 + х + (-2)3 = 0 х = +4

Глава 4. Энергетика химических реакций, химическая
кинетика и химические равновесия
Энергетика химических реакций
С энергетической точки зрения химические реакции принято делить на экзотермические, идущие с выделением тепла (+ Q), и эндотермические (- Q) идущие с поглощением тепла. Выделяемое или поглощаемое тепло называется тепловым эффектом химической реакции.
В результате химической реакции запас внутренней энергии исходных веществ изменяется, что при постоянном давлении выражается в виде изменения термодинамической функции, называемой энтальпией и обозначаемой Н.
Изменение энтальпии системы, где происходит реакция, равно выражению
∆ Н = ∆ U + p ∆ V,
где ∆ Н — изменение энтальпии системы;
∆ U — изменение внутренней энергии системы;
p ∆ V — работа по изменению объема системы при постоянном давлении Р;
∆ V — изменение объема системы.
В случае экзотермической реакции система теряет энергию, внутренняя энергия ее уменьшается, поэтому изменение энтальпии отрицательно:
∆ Н < 0.
Система как бы “теряет”часть своей “теплоты” при экзотермической реакции; соответственно при эндотермической реакции система “приобретает тепло” от окружающей среды.
Тепловой эффект химической реакции (Q) описывает энергетический результат с точки зрения окружающей среды, а изменение энтальпии (∆ Н) — с точки зрения системы, в которой происходит реакция.
Поэтому ∆ Н = - Q или Q = -∆ Н.
При экзотермической реакции Q > 0 (положительно), ∆ Н < 0 (отрицательно). Тепло выделяется, система его теряет.
Если Q < 0, а ∆ Н > 0, то реакция — эндотермическая: идет поглощение тепла и приобретение энергии.
Примеры
N2+3H2 = 2NH3 + 92 кДж, ∆ Н = –92 кДж.
Реакция — экзотермическая; при образовани двух молей аммиака выделяется 92 кДж.
N2+О2 = 2NО – 181 кДж, ∆ Н = + 181 кДж.
При образовании двух молей оксида азота (II) поглощается 181 кДж; реакция — эндотермическая.
При энергетическом описании химической реакции, ее возможности протекания и оценке ее энергетического эффекта, помимо энтальпии, используют такие функции как энтропию (S), так и энергию Гиббса (G).
Н, S, и G — называются основными термодинамическими функциями. Они являются функциями состояния системы и не зависят от пути процесса, а только от состояния исходных и конечных веществ реакции — в соответствии с законом Гесса.
Энтропия (S) чаще всего трактуется как функция неупорядоченности системы. Чем в меньшей степени структурирована система, тем больше ее энтропия. Наиболее неупорядоченным среди трех агрегатных состояний является газообразное состояние, которое и характеризуется большими значениями энтропии.
Так, абсолютное значение энтропии при 25º С и 1атм твердого NaCl равно 72 Дж/моль · К, а газообразного СО2 равно 214 Дж/(моль · К).
В природе энтропия проявляет себя как правило следующим образом — наиболее вероятным является состояние с большим беспорядком, с большим значением энтропии. Поэтому энтропия стремится к постоянному увеличению. Противодействовать увеличению беспорядка может только порядок, только взаимодействие, притяжение друг к другу компонентов системы. Поэтому в химии, да и не только в химии, часто связывают воедино два противоположных по смыслу фактора: энтальпийный (фактор соединения) и энтропийный (фактор разъединения).
Разность этих факторов приводит к изменению энергии Гиббса (∆ G), которое определяет возможность или невозможность протекания химической реакции.
∆ G = ∆ Н – Т ∆ S,
где ∆ G — изменение энергии Гиббса;
∆ Н — изменение энтальпии (энтальпийный фактор);
∆ S — изменение энтропии;
Т — абсолютная температура;
Т∆S — энтропийный фактор.
Возможны такие химические реакции, которые сопровождаются уменьшением энергии Гиббса, отрицательным ее изменением:
∆ G < 0.
Далее обратимся к термодинамическим расчетам. При расчетах будем использовать табличные значения стандартных значений энтальпии образования и абсолютных энтропий конкретных веществ.
Стандартным изменением энтальпии образования, или стандартной энтальпией образования вещества называется изменение энтальпии в реакции образования одного моля вещества из простых веществ при стандартных условиях: температуре 25º С (298 К) и давлении 1,013·105 Па, или1атм, или 760 мм рт.ст.
Примеры
1.Стандартные энтальпии образования жидкой и газообразной воды соответствуют следующим реакциям
H2 + ½O2 = H2O(ж) ∆ Н о = –286 кДж/моль.
Ноль наверху ∆Но указывает на стандартные условия
H2 + ½O2 = H2O(газ) ∆ Н о = –242 кДж/моль.
286 кДж выделяется при образовании одного моля жидкой воды (18 г/моль) из одного моля газообразного молекулярного водорода (2 г/моль) и половины моля газообразного кислорода (16 г/моль).
Разность между теплотами образования газообразной и жидкой воды является теплотой парообразования:
H2O(ж) = H2O(газ) ∆ Н о = +44 кДж/моль.
2. Образованию одного моля CaCO3 соответствует следующее уравнение реакции:
Ca(тв) + C(графит) + 3/2O2(газ) = CaCO3(тв) ∆ Н о = –1206 кДж/моль.
Энтальпии образования простых веществ равны нулю. Если простое вещество имеет не одну аллотропическую модификацию, то нулевое значение приписывается как правило наиболее распространенной модификации.
При расчетах благодаря тому, что рассматриваемые термодинамические функции (H, S и G) являются функциями состояния (подчиняются закону Гесса), измение функции в химической реакции представляет собой разность алгебраических сумм значений функций конечных веществ и алгебраических сумм значений функций исходных веществ.
 |
Примеры
1. Рассчитаем изменение основных термодинамических функций в результате горения метана при стандартных условиях и ответим на вопрос: возможна ли эта реакция?
Составим уравнение химической реакции и под формулами веществ в первой строке напишем взятые из справочника термодинамических величин значения стандартных энтальпий образования веществ, а во второй строке — их абсолютные стандартные энтропии.
CH4 + 2O2 = CO2 + 2H2O
∆ Н о –75 0 –394 –286 кДж/моль
S о 186 205 214 70 кДж/(моль · К)
Обратите внимание на то, что ∆ Н выражено в кДж/моль, а S — в Дж/(моль· К).
∆ Н о = –394 – 2 · 286 – (–75) = 891 кДж,
∆ S о = 214 + 2 · 70 – 186 – 2 · 205 = –242 Дж/К.
При вычислении Δ G о используем уравнение
Δ G = ∆ Н – T ∆ S
Δ G о = –891 + 298 · 0,242 = –819 кДж,
∆ Н о = –891 кДж; ∆ S о = –242 Дж/К; ΔGо = –819 кДж.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 580; Нарушение авторских прав?; Мы поможем в написании вашей работы!