
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Могилев, М. Е. 5 страница
|
|
|
|
[Ag(NО2)]- — К Н = 1,8·10-3
[Ag(СN)2]- — КН = 1,1·10-21
[Ag(NH3)2]+ — КН =9,3·10-8
Сравнивая эти комплексы, можно сказать, что самым прочным комплексом является цианидный комплекс, так как его константа нестойкости наименьшая.
Упражнения
1. Составить формулу комплексного соединения, состоящего из комплексообразователя — Fe+++ и лигандов — ионов F-; n = 6. В состав внешней координационной сферы поместите либо ионы натрия, либо ионы хлора.
Решение
Формула комплексного иона: [FeF6]---. Это — анион, поэтому в состав внешней координационной сферы входят катионы натрия:
Na[FeF6] — гексафтороферрат (III) натрия.
2. То же самое сделать с Cu++; Cu+; лигандами СN- и NH3; n Cu++=4; n Cu+=2.
Ответ
[Cu(NH3)4]Cl2 — хлорид тетрамминмеди (II);
Nа2[Cu(СN)4] — тетрацианокупрат (II) натрия;
[Cu(NH3)2]Cl — хлорид диамминмеди (I);
Nа[Cu(СN)2] — дицианокупрат (I) натрия;
Контрольная работа
Далее приводятся контрольные задания, содержащие по десять вопросов, соответствующих темам, рассмотренным в пособии.
При решении задач используйте таблицы данные в приложении.
При выборе номера задания следует ориентироваться на Ваш номер зачетной книжки. Последние две цифры номера — это число, которое нужно разделить на 20(если оно больше 20), т.к. представлено только 20 вариантов. Остаток деления дает Вам номер задания, которое надо выполнить. Студенты, номера зачеток которых заканчиваются на 20,40,60,80,100 – делают 20 вариант.
Пример: 71 делить 20 = 3 и 11 в остатке. 11 — это номер Вашего задания.
Другие примеры:
| Последние две цифры в зачетной книжке | Номер задания |
| 01; 02; ……10; ……20 | 1; 2; ……10; ……20 |
| 21; ……30; ……40 | 1; ……10; ……20 |

Образец выполнения задания
1. Напишите молекулярную и структурную формулы следующих солей: гидроселената магния и перхлората гидроксостронция. Каким основаниям, кислотам и оксидам соответствуют эти соли?
2. Какова формула кристаллогидрата гидрофосфата кальция? Его состав: Са — 23,3 %; Н — 2,91 %; Р — 18,0 %; О — 55,8 %.
3. Электронная конфигурация внешнего электронного слоя некоторого химического элемента 3 s 23 р 3. Какой это химический элемент? Сколько протонов и нейтронов содержит изотоп этого химического элемента с массовым числом 31? Приведите примеры соединений данного химического элемента.
4. При некоторой температуре установилось равновесие в химической системе 2SO2 + O2 = 2SO3
при следующих концентрациях веществ: [O2] = 0,07 моль/л; [SO2] = 0,04 моль/л; [SO3] = 0,05 моль/л.
Каковы были исходные концентрации кислорода и сернистого газа? В какую сторону сместится равновесие этой реакции при следующих условиях:
1) повышении давления и 2) нагревании?
5. В 2 л воды растворили 500 г SrCl2·6Н2О. Рассчитайте для полученного раствора массовую долю в процентах (процентную концентрацию), молярность. Плотность раствора 1,11 г/мл.
6. Составьте ионное уравнение из молекулярного и молекулярное из ионного:
1) СаСО3 + НCl →
2) Н+ + ОН- →
7. Напишите уравнения возможных реакций гидролиза в ионной и молекулярной формах и укажите характер среды растворов этих солей (рН > 7; < 7 или ≈ 7): NH4NO2; NH4NO3; NaCl; CdCl2; Rb2SO3.
8. Составьте уравнение реакции
K2Cr2O7 + H2O2 + H2SO4 →
9. Составьте формулы комплексных соединений одно- и двухвалентной меди, если их координационные числа соответственно равны 2 и 4. В качестве лигандов используйте: 1) молекулы аммиака и 2) анионы CN–. В состав внешней координационной сферы включите либо ионы Na+, либо ионы Cl–.
Ответы на вопросы задания
Вопрос 1
1. Гидроселенат магния — это соль селеновой кислоты H2SeO4 и гидроксида магния Mg(ОН)2, а также оксидов SeО3 и MgО.
Их структурные формулы:
 | |||
 |
Остаток основания в соли:
 Соль — кислая, поэтому в кислотном остатке содержится незамещенный атом водорода:
Соль — кислая, поэтому в кислотном остатке содержится незамещенный атом водорода:
Молекулярная формула: Mg(HSeO4)2
 |
Структурная формула:
2. Хлорат гидроксостронция — соль гидроксида стронция Sr(ОН)2 и хлорной кислоты HСlO4
 Их структурные формулы:
Их структурные формулы:
 Соль — основная, поэтому в остатке основания содержится незамещенная группа “ОН”:
Соль — основная, поэтому в остатке основания содержится незамещенная группа “ОН”:
 Остаток кислоты:
Остаток кислоты:
Молекулярная формула: MgОHСlO4.
 |
Структурная формула:
Вопрос 2
1. В условиях задачи дано содержание каждого из элементов в процентах (подразумеваются массовые проценты). Поэтому мы вправе предположить, что для расчетов можно взять 100 г вещества. Тогда в 100 г вещества масса каждого из химических элементов будет равна:
кальция—23,3 г; водорода—2,91 г; фосфора—18,0 г; кислорода—55,8 г.
Рассчитаем количество молей атомов химических элементов в 100 г соединения (n), учитывая их атомные массы:
 |
Чтобы количество каждого атома не было дробным числом, разделим полученные числа на наименьшее из них. Получим
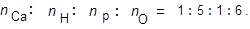 |
Общая формула вещества: СаН5РО6.
Формула безводного гидрофосфата кальция: СаНРО4.
Наличие лишних 4-х атомов водорода и 2-х атомов кислорода говорит о содержании в кристаллогидрате 2-х молекул воды.
Итак, формула кристаллогидрата: СаНРО4·2Н2О.
2. Так как в одном моле гидрофосфата кальция содержится один моль атомов водорода, то для его нейтрализации при превращении кислой соли потребуется 1 экв щелочи.
Например:
3СаНРО4 + 3NаОН = Са3(РО4)2 + Nа3РО4 + 3Н2О
3 экв 3 экв
Вопрос 3
1. Во внешнем электронном слое химического элемента содержатся электроны 3 s 23 р 3. Внешний слой — третий (n = 3), его образуют 2 электрона с l = 0 и 3 электрона с l = 1
Состав внешнего электронного слоя данного химического элемента указывает на то, что он в Периодической таблице находится на пересечении 3-его периода и 5-й группы (главной подгруппы). Это — фосфор.
Напишем его полную электронную конфигурацию
Р: 1 s 22 s 22 p 63 s 23 p 3.
То же с помощью квантовых ячеек:
 |
2. В ядре атома фосфора с массовым числом 31 содержится 15 протонов и 16 нейтронов (31-15=16).
15 — порядковый номер фосфора в Периодической системе Д. И. Менделеева.
3. В химических соединениях фосфор чаще всего проявляет степени окисления: –3; 0; +3; +5.
Примеры соединений, соответствующие этим степеням окисления:
–3
P: РН3 — фосфин; Nа3Р; Са3Р2 — фосфиды.
0
Р: Белый и красный фосфор.
+3
Р: Р2О3 — оксиды фосфора (III), или фосфористый ангидрид; Н3РО3 — фосфористая кислота и ее соли.
+5
Р: Р2О5 — оксид фосфора (V), или фосфорный ангидрид; фосфорные кислоты Н3РО4, НРО3, Н4Р2О7 и их соли.
Вопрос 4
1) Сначала определим исходные концентрации веществ — сернистого газа и кислорода. Для этого под формулами веществ реакции напишим три вида концентраций:
а) концентрации веществ в первоначальный момент (исходные концентрации);
б) изменение концентраций в результате химической реакции, дошедшей до состояния равновесия;
в) концентрации веществ в момент равновесия:
2SO2 + O2 Û 2SO3
Исходные концентрации: 0,09 0,095 0
Изменение концентраций: 0,05 0,025 0,05
Равновесные концентрации: 0,04 0,07 0,05
Для образования 2 моль SO3 требуется согласно уравнению реакции 1 моль O2 и 2 моль SO2, а для образования 0,05 моль SO3 — 0,025 моль O2 и 0,05 моль SO2.
Следовательно, исходные концентрации соответственно равны:
[SO2]исх = 0,04 + 0,05 = 0,09 моль/л,
[O2]исх = 0,07 + 0,025 = 0,095 моль/л.
2. В результате прямой реакции происходит уменьшение числа молей газообразных веществ; поэтому при повышении давления, согласно принципу Ле Шателье равновесие смещается вправо.
3. Для того чтобы узнать, как повлияет нагревание, рассчитаем тепловой эффект химической реакции (изменение энтальпии). Под формулами веществ подпишем справочные стандартные энтальпии образования веществ (см. табл А.2).
2SO2 + O2 Û 2SO3
D Н °: –297 0 –395 кДж/моль
D Н ° реакции = –2 · 395 + 2 · 297 = –196 кДж
Изменение энтальпии при образовании 2 моль SO3 равно: Δ Н 0 = –196 кДж.
Прямая реакция — экзотермическая. Поэтому при нагревании в соответствии с принципом Ле Шателье равновесие будет смещаться в левую сторону — в сторону эндотермической реакции.
4. Заодно ответим и на вопрос: возможна ли реакция?
Рассчитаем изменение энтропии в процессе реакции, используя справочные стандартные значения абсолютных энтропий:
| 2SO2 + O2 = 2SO3 | |||
| S0 | 256 Дж/(моль·К) | ||
| ΔS0 = 2·256-205-2 ·248 = -189 Дж/К |
ΔS0 = –189 Дж/К
Уменьшение энтропии понятно: уменьшается число молей газообразных веществ.
Теперь рассчитаем стандартное изменение энергии Гиббса:
ΔG0 = ΔН0 – ТΔS0 = –196 + 298 · 0,189 = –140 кДж,
ΔG0 = –140 кДж,
ΔG0 < 0, поэтому реакция возможна.
Однако при обычных условиях реакция не протекает из-за большой величины энергии активации (Еа).
Преодолению энергии активации (активационного барьера) способствует введение катализатора, в частности платины.
Вопрос 5
Так как в 2 л (2000 г) воды растворили 500 г кристаллогидрата SrCl2·6Н2О, то общая масса раствора оказалась равной
2000 г + 500 г = 2500 г.
В образовавшемся растворе масса воды увеличилась за счет кристаллизационной воды кристаллогидрата. Для дальнейших расчетов необходимо узнать, сколько воды, а также безводной соли содержится в 500 г SrCl2·6Н2О.
Молярная масса SrCl2: 87,6 + 71 = 158,6 г/моль.
87,6 — атомная масса стронция.
Масса шести молей воды: 6 · 18 = 108 г.
Молярная масса SrCl2·6Н2О: 158,6 + 108 = 266,6 г/моль.
В 266,6 г кристаллогидрата содержится 158,6 г безводной соли и 108 г кристаллизационной воды.
Далее узнаем, сколько соли и воды находится в 500 г кристаллогидрата:
| SrCl2: | 266,6—158,6 | m SrCl2 = 297 г |
| 500— m SrCl2 | ||
| Н2О: | 266,6—108 | m Н2О = 203 г |
| 500— m Н2О |
Общая масса воды в растворе: 2000 г + 203 г = 2203 г.
В 2500 г раствора содержится 297 г SrCl2.
Теперь можно перейти к расчету разных способов выражения концентраций для данного раствора.
Процентная концентрация (Р)
 |
Молярность (СМ)
Масса 1л раствора: 1,11 г/мл · 1000 мл = 1110 г/л.
Содержание соли в растворе: 1110 · 0,119 = 132,1 г.
Количество молей соли: 132,1/ М SrCl2 = 132,1/158,6 = 0,833 моль/л.
С М = 0,833 моль/л.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 896; Нарушение авторских прав?; Мы поможем в написании вашей работы!