
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Могилев, М. Е. 4 страница
|
|
|
|
Поэтому уравнения в молекулярной и ионных формах будут следующими:
НNO3 + NaOH Û NaNO3 + Н2О
Н+ + OH- Û Н2О
В исходных растворах есть готовые для реакции ионы до смешивания, поэтому в процессе реакции диссоциации НNO3 и NaOH не происходит, так как НNO3 и NaOH — сильные электролиты.
2. Сольем растворы азотистой кислоты и гидроксида натрия. Уравнение в молекулярной форме:
НNO2 + NaOH Û NaNO2 + Н2О
| Раствор кислоты | Раствор основания | |
| НNO2 Û Н+ + NO2- | Na+; OH- |
В растворе кислоты из-за того, что она слабый электролит, концентрации ионов водорода явно недостаточно для того, чтобы произошло связывание их ионами OH-. Поэтому при сливании растворов НNO2 “вынуждена” диссоциировать для образования достаточного для реакции количества ионов Н+. В исходном растворе кислоты до смещения равновесие диссоциации сильно смещено влево, но под действием щелочи (ионов гидроксила) при сливании растворов равновесие диссоциации кислоты смещается. Поэтому при написании ионного уравнения необходимо учитывать не только связывание ионов Н+ и OH-, но и “вынужденную” реакцию диссоциации НNO2:
ìНNO2 Û Н+ + NO2-
+ í
îН+ + OH- Û Н2О
______________________
НNO2+ OH-Û NO2-+ Н2О
В окончательном ионном уравнении слабый электролит, а также осадок и газ записываются в молекулярном виде потому, что именно эти вещества подвергаются диссоциации, разложению или ассоциации, если они образуются в результате реакции.
Итак, способ составления ионных уравнений предполагает написание формул слабых электролитов, осадков и газов в молекулярном, недиссоциированном виде, потому что именно они-то и диссоциируют (или ассоциирует).
Примеры
1. Составьте уравнение реакции в ионной форме.
СaCO3 + 2HCl = CaCl2 + CO2 + H2O,
где СaCO3 — плохо растворимое вещество;
HCl — сильный электролит: в растворе НСl до реакции имеется достаточное количество ионов для реакции;
CaCl2 — хорошо растворимая соль;
СО2 — газ; Н2О — слабый электролит.
Поэтому уравнение реакции в ионной форме
СaCO3 + 2H+ = Ca++ + CO2 + H2O.
Это общее ионное уравнение предполагает следующие два уравнения:
ì СaCO3 = Ca++ + CO3– –
í
î CO3– – + 2H+ = CO2 + H2O
____________________________
СaCO3 + 2H+ = Ca++ + CO2 + H2O
А теперь составим молекулярное уравнение, исходя из ионного. Допустим, требуется написать уравнение реакции в молекулярной форме для ионного уравнения
H+ + HCO3– = CO2 + H2O
В качестве источника ионов водорода можно взять любую кислоту, но только сильную: HCl, HNO3 и др.
Ионы НСО3– могут иметь в растворе хорошо растворимые гидрокарбонаты NaHCO3, KHCO3, Ca(HCO3)2 и другие, т. е. одному ионному уравнению могут соответствовать несколько молекулярных.
HNO3 + NaHCO3 = CO2 + H2O + NaNO3
2HCl + Ca(HCO3)2 = 2CO2 + CaCl2 + 2H2O и др.
В ионном уравнении здесь также можно предположить две стадии:
ì HCO3– = H+ + CO3– –
í
î CO3– – + 2H+ = CO2 + H2O
_________________________
H+ + HCO3– = CO2 + H2O
2. Составить молекулярное уравнение для ионного:
HCO3– + ОН– = H2O + CO3– –
Такими уравнениями могут быть:
NaHCO3 + NaOH = H2O + Na2CO3
2NaHCO3 + 2KOH = 2H2O + Na2CO3 + K2CO3 и др.
Глава 7. Гидролиз солей
Гидролизом соли называется следующая ступень гидратации ионов соли, идущая с разложением (диссоциацией) молекулы воды.
Гидролизу подвергаются те ионы, при взаимодействии которых с молекулами воды образуются либо слабые основания, либо катионы основной соли, либо слабые кислоты, либо анионы кислых солей, т. е. гидролизуются соли, содержащие катионы слабых оснований, или анионы слабых кислот, или и те и другие.
В качестве примеров приведенных ионов: Na+, K+, Zn++, NH4+, Cl–, NO3–, SO3– –, SO4– – гидролизуются ионы Zn++, NH4+ и SO3– –.
Гидролиз этих ионов приводит к образованию кислой или щелочной среды:
Zn++ + H2O Û ZnOH+ + H+
NH4+ + H2O Û NH4OH + H+
SO3– – + H2O Û HSO3– + OH–
Примеры
1. Гидролиз карбоната натрия Na2CO3.
Раствор этой соли содержит ионы натрия Na+ и ионы СО3– –. Гидролизуется ион СО3– –, так как он является анионом слабой кислоты:
СО3– – + Н2О Û НСО3– + ОН–
НСО3– + Н2О Û Н2СО3 + ОН–
Вторая стадия идет значительно хуже первой, так как заряд аниона HCO3– на единицу меньше заряда иона CO3– – и ионы OH– первой стадии подавляют вторую. Поэтому можно не принимать ее во внимание.
Следовательно, гидролиз Na2CO3 выражается уравнением
CO3– – + H2O Û HCO3– + OH–
Na2CO3 + H2O Û NaHCO3 + NaOH
В молекулярной форме приведена формула кислой соли – гидрокарбоната натрия.
Образование ионов OH– приводит к щелочной среде раствора: рН > 7.
2. Гидролиз хлорида аммония NH4Cl.
В растворе содержатся ионы NH4+ и Cl–. Ионы хлора не гидролизуются: HCl – сильная кислота. Гидролизу подвергается ион аммония NH4+:
NH4+ + H2O Û NH4OH + H+
NH4Cl + H2O Û NH4OH + HCl
Среда кислая, рН < 7.
 Гидролиз — обратимый процесс. Напишем выражение константы гидролиза (К г):
Гидролиз — обратимый процесс. Напишем выражение константы гидролиза (К г):
Концентрацию воды можно считать постоянной.
Умножим числитель и знаменатель на одну и ту же величину [OH–]:
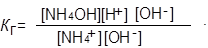 |
Тогда в написанном выражении можно увидеть ионное произведение воды: К w = [H+][OH–] в числителе и константу диссоциации NH4OH в знаменателе:
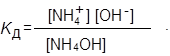
Следовательно:

Константа гидролиза соли (иона) тем больше, чем больше К w, которая заметно изменяется с изменением температуры, и чем меньше K Д, т. е. чем слабее получающийся электролит.
3. Гидролиз сульфата меди CuSO4.
Cu+ + + H2O Û CuOH+ + H+
2CuSO4 + 2H2O Û (CuOH)2SO4 + H2SO4
Образовалась основная соль (катион основной соли); среда – кислая pH < 7.
4. Гидролиз нитрита аммония NH4NO2.
ì NH4+ + H2O Û NH4OH + H+
í NO2– + H2O Û HNO2 + OH–
î H+ + OH– = H2O
_________________________________
NH4+ + NO2– + H2O Û NH4OH + HNO2
NH4NO2 + H2O Û NH4OH + HNO2
Гидролизуются и катион, и анион, получаются в реакции слабое основание и слабая кислота. Поэтому среда близка к нейтральной pH ≈ 7.
Глава 8. Окислительно-восстановительные реакции
Окислительно-восстановительными реакциями называются реакции, сопровождающиеся переходом электронов от одних частиц к другим. В результате этого изменяются степени окисления химических элементов в веществах. Поэтому можно считать признаком окислительно-восстановительной реакции изменение степени окисления некоторых химических элементов в реакции.
Вещества, отдающие электроны, называются восстановителями – они в процессе реакции окисляются; вещества, принимающие электроны, называются окислителями, которые в реакции восстанавливаются.
Пример
NaNO2 + NaJ + H2SO4 → NO + J2 + Na2SO4 + H2O
В результате реакции изменяются степени окисления азота и иода, что покажем в виде схемы
+3 +2
N + 1e– = N │ · 2
–1 0 │
2J - 2e– = J2 │
NaNO2 – окислитель; NaJ – восстановитель.
В соответствии со схемой изменения степеней окисления поставим коэффициенты в уравнении реакции.
2NaNO2 + 2NaJ + H2SO4 = 2NO + J2 + Na2SO4 + H2O
Напомним для тех, кто забыл, как находится степень окисления химического элемента в веществе.
Степенью окисления называется условный заряд атома при предположении, что в химической связи его с другим атомом произошло полное смещение электронной пары в сторону одного из атомов – в сторону более электроотрицательного, т. е. при предположении наличия в веществе только ионных связей. Степень окисления элемента в простом веществе равна нулю.
NaNO2. Напишем степени окисления элементов над их символами:
+1 –2
NaNO2
Определим степень окисления азота:
+1 + x – 4 = 0; x = +3
+3
NaNO2
+1 –1
NaJ. Здесь все очевидно: NaJ
+1 Х –1
H2SO4 H2SO4
2 + x – 8 = 0; x = +6
+6
H2SO4
+2 –2
NO NO
0
J2. Простое вещество, поэтому J2
+1 +6 –2
Na2SO4 Na2SO4
+1 –2
H2O H2O
Во многих химических реакциях имеет место следующая функциональная схема реакции:
Ок + В + С →
Где Ок – окислитель;
В – восстановитель;
С – среда. “Средой” назовем вещество, в котором не происходит изменения степени окисления химического элемента, но оно необходимо для протекания реакции. Так, наличие определенной среды — кислой, щелочной или нейтральной — очень часто необходимо для протекания окислительно-восстановительной реакции.
В рассмотренной только что реакции роль среды выполняет H2SO4.
Еще один пример окислительно-восстановительной реакции:
0 +5 +2 +2
Cu + HNO3 → Cu(NO3)2 + NO + H2O
0 +2
ì Cu – 2ē = Cu │·3
í +5 +2 ½
î N + 3ē = N │·2
Соотношение между количествами восстановителя Cu и окислителя (HNO3) – 3: 2.
3Cu + 2HNO3 → 3Cu(NO3)2 + 2NO + H2O
Однако HNO3 — не только окислитель, но и выполняет функцию среды: связывает получающуюся двухвалентную медь в нитрат меди.
Поэтому получаем окончательное уравнение
3Cu + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
В Ок С
или
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Составление уравнений окислительно-восстановительных реакций при неизвестных продуктах реакций значительно сложнее. В этом случае требуется знание важнейших степенней окисления химических элементов и некоторых конкретных свойств их соединений.
Рекомендации по составлению полного уравнения окислительно-восстановительной реакции при неизвестных продуктах можно свести к следующему. Это умение связано с уменим находить наиболее вероятные продукты реакции.
Рассмотрим сказанное на примере. Пусть требуется составить уравнение
FeSO4 + NaClO3 + NaOH →
1. Сначала определим, может ли быть реакция окислительно-восстановительной, т. е. есть ли в веществах атомы химических элементов,склонных к изменению степеней окисления.
+2 +5
Таковыми являются Fe и Cl:
+2 +5
FeSO4 + NaClO3 + NaOH →
2. Укажем на основные степени окисления тех химических элементов, которые могут изменить степень окисления в данной реакции:
0 +2 +3 –1 0 +1 +3 +4 +5 +7
Fe, Fe, Fe; Cl, Cl, Cl, Cl, Cl, Cl, Cl.
Наиболее характерная степень окисления хлора подчеркнута.
3. Напишем предполагаемые схемы изменения степеней окисления элементов таким образом, чтобы, во-первых, одновременно имело место окисление и восстановление и, во-вторых, были бы учтены тенденции элементов к приобретению наиболее часто проявляемых ими степеней окисления.
+5 –1
Cl + 6ē = Cl
+2 +3
Fe – ē = Fe
4. Присвоим каждому из исходных веществ определенную функцию: окислителя или восстановителя, или, возможно, среды.
В данном случае
окислитель – NaClO3;
восстановитель – FeSO4;
вещество среды – NaOH.
5. В правой части уравнения реакции укажем наиболее вероятные продукты в соответствии со схемой изменения степеней окисления и условиями, в частности, характером среды (кислая, щелочная, нейтральная); реакция протекает при сплавлении, в газообразной фазе и т. д.
В рассматриваемой реакции с учетом щелочной среды соединением железа со степенью окисления +3 будет гидроксид железа (III), а наиболее вероятное соединение хлора после реакции –хлорид натрия:
FeSO4 + NaClO3 + NaOH → Fe(OH)3 + NaCl
6. Подберем коэффициенты перед формулами веществ в уравнении реакции в соответствии со схемой изменения степеней окисления:
6FeSO4 + NaClO3 + 12NaOH → 6Fe(OH)3 + NaCl + 6Na2SO4
Для уравнивания количества кислорода и водорода оказывается необходимым к левой части уравнения прибавить 3 молекулы воды. Получим окончательное уравнение:
6FeSO4 + NaClO3 + 12NaOH + 3H2O = 6Fe(OH)3 + NaCl + 6Na2SO4
Глава 9. Гальванический процесс и электролиз
Гальваническим процессом называется процесс получения электрического тока в результате самопроизвольно протекающей химической окислительно-восстановительной реакции. Подобный процесс осуществляется в устройстве, называемом гальваническим элементом.
Классическим примером гальванического элемента является медно-цинковый гальванический элемент (элемент Даниэля-Якоби).
Гальванический элемент состоит из двух полуэлементов:
1) цинковая пластина (цинковый электрод) опущена в водный раствор сульфата цинка;
2) медный электрод опущен в раствор сульфата меди.
Оба электрода соединены металлическим проводником (проводник I рода), а водные растворы замкнуты электролитическим ключом, в котором происходит движение ионов (проводник II рода).
Во внешней электрической цепи создается разность электрических потенциалов (ЭДС) за счет разных электродных потенциалов (φ) на границах “металл—раствор” в обоих полуэлементах, соответствующих следующим уравнениям:
(-): Zn – 2e– = Zn++
(+): Cu++ + 2e– = Cu
Zn + Cu++ = Zn++ + Cu
В молекулярной форме
Zn + CuSO4 = ZnSO4 + Cu
Происходит окислительно-восстановительная реакция:
Zn – восстановитель;
Cu++(CuSO4) — окислитель.
Общая реакция разбита на две части — полуреакции: окисление цинка и восстановление меди. Передача электронов, отдаваемых цинком и принимаемых ионами меди, происходит не при непосредственном контакте веществ, а через внешнюю цепь. В этом заключается суть гальванического процесса.
Электродные потенциалы отнесены к стандартному платино-водородному электроду, потенциал которого в стандартных условиях ([H+] = 1моль/л;
p = 1,013·105 Па; T = 298К (25 °C)) принят за ноль
2H+ + 2e– ↔ H2 φH0 = 0.
Электродные потенциалы медного и цинкового электродов при концентрациях ионов, равных 1 моль/л, соответственно равны:
Cu++ + 2ē = Cu φCu0 = + 0,34 В,
Zn++ + 2ē = Zn φZn 0 = - 0,76 В.
ЭДС (Е) такого гальванического элемента при единичных концентрациях равна:
Е = φCu0 - φZn 0 = +0,34В – (-0,76 В) = 1,10 В.
При концентрациях, отличных от единицы, следует использовать уравнение Нернста (при 25 ºС, т. е. при 298 К):
φ = φ0 + (0,059/n) · lg[Меn+],
где φ — электродный потенциал данной полуреакции при С ≠1 (С —концентрация);
φ0 — стандартный электродный потенциал;
n — число электронов, присоединяемых ионом металла, или заряд иона;
lg — десятичный логарифм.
Уравнение полуреакции:
Меn+ + nē = Ме
 Схематачески рассматриваемый медно-цинковый гальванический элемент можно изобразить следующим образом:
Схематачески рассматриваемый медно-цинковый гальванический элемент можно изобразить следующим образом:
Задача
Вычислить ЭДС следующего гальванического элемента и показать процессы, происходящие в нем:
Sn│SnSO4││CuSO4│Cu
0,01М 0,001М
Под формулами веществ написаны их молярные концентрации.
Решение
По таблице стандартных электродных потенциалов находим
φSn0 = -0,14 В, φCu0 =+0,34 В.
Используя уравнение Нернста, вичислим φSn и φCu.
φSn = -0,14 + (0,059/2)·lg[10-2] = -0,14 - 0,06 = -0,20 В,
φCu = +0,34 + (0,059/2)·lg[10-3] = +0,34 – 0,09 = +0,25 В,
Е = +0,25 – (-0,20) = 0,45 В
Реакции, происходящие в данном гальваническом элементе:
| (-):Sn - 2ē = Sn++ |
| (+):Cu++ + 2ē = Cu |
| Sn + Cu++ = Sn++ + Cu |
Sn + CuSO4 = SnSO4 + Cu
Пример
Каково значение электродного потенциала водородного электрода не при [Н+] = 1 моль/л, а в нейтральной среде?
В нейтральной среде [Н+] = 10-7 моль/л.
Для полуреакции: 2Н+ + 2ē = Н2.
В стандартных условиях электродный потенциал равен нулю:
φН0 = 0.
При концентрациях ионов водорода [Н+] = 10-7 моль/л
φН = φН0+ (0,059/1) · lg[Н+] = 0 + 0,059·lg[10-7] = –0,41 В
φН = -0,41 В
Т. е. в нейтральной среде φН = -0,41В при [Н+] = 10-7 моль/л или рН=7.
Так как рН= –lg[Н+], то для “водородной полуреакции”
2Н+ + 2ē = Н2
уравнение Нернста можно написать в следующем виде:
φН = -0,059 рН
Примеры
| Для рН = 0 | φН0 = 0 (это и есть стандарт); |
| для рН = 5 | φН = -0,30 В; |
| для рН = 10 | φН = -0,59 В; |
| для рН = 14 | φН = -0,83 В. |
Электролиз
Электролизом называется химический процесс, происходящий в результате пропускания через расплав или раствор электролита постоянного электрического тока.
В отличие от гальванического процесса электролиз — несамопроизвольный процесс: окислительно-восстановительные реакции при электролизе протекают под воздействием внешнего источника тока. На электродах — катоде (-) и аноде (+) — разряжаются вещества в определенной последовательности.
При электролизе водного раствора, содержащего катионы металла, расположенного в ряду стандартных электродных потенциалов (в ряду активности металлов) правее алюминия, т. е. при φ > –1,66 В, на катоде выделяется металл.
При электролизе растворов, содержащих ионы металла, расположенного в ряду стандартных электродных потенциалов левее алюминия включительно, разряжаются ионы водорода с выделением свободного водорода, точнее — вода в соответствии с полуреакцией
2Н2О + 2ē = Н2 + 2ОН–
На аноде в первую очередь разряжаются анионы бескислородных кислот Cl-; Br-; I-; S--, исключая ионы F-. В присутствии кислородсодержащих анионов SO4--; CO3--; NO3-…, а также F- на аноде происходит полуреакция с выделением свободного кислорода:
2Н2О - 4ē = О2 + 4Н+
Количество (масса, объем) выделившегося на электроде вещества подчиняется законам Фарадея, что можно выразить формулой
m = (m Э · Q)/ F или m = (m Э · I·τ)/ F,
где m — масса выделившегося вещества, г;
m Э — его эквивалентная масса, г/экв;
Q — количество электричества, Кл;
F — число Фарадея, равное 96500 Кл;
I — сила тока, А;
τ — время пропускания тока, с.
Задача
Какие вещества и в каких количествах (масса, объем) образуются при электролизе раствора, содержащего 5,85г NaCl. Какое количество электричества требуется для разложения всей соли?
Решение
На катоде ионы натрия не разряжаются, так как электродный потенциал Na очень мал: φNa0 = -2,71В, а разлагается вода; а на аноде разряжаются ионы Cl-.
Электролиз происходит в соответствии с уравнениями
ì(-)К: 2Н2О + 2ē = Н2 + 2ОН-
+ í
î(+)А:2Cl- - 2ē = Cl2
____________________________
2Н2О + NaCl = Н2 + 2NaОН + Cl2
2Н2О + 2Cl- = Н2 + 2ОН- + Cl2
2Н2О + 2NaCl = Н2 + 2NaОН + Cl2
Молярная масса NaCl — 58,5 г/моль. Разложилось 5,85 г. Это 0,1 моль или 0,1 экв. соли.
Следовательно:
пропущено 9650 Кл электричества, т. е. 0,1 F;
разложилось и образовалось каждого вещества по 0,1 экв, что приводит к следующим величинам, которые укажем под формулами веществ в уравнении химической реакции:
2Н2О + 2NaCl = Н2 + 2NaОН + Cl2
0,1экв 0,1экв 0,1экв 0,1экв 0,1экв
1,8 г 5,85 г 0,1 г 4 г 3,55 г
1,12 л (н.у.) 1,12 л (н.у.)
Полученные результаты находятся в полном соответствии с законами Фарадея, которые можно считать частным случаем более общего закона — закона эквивалентов.
Глава 10. Комплексные соединения
Комплексными соединениями называются вещества, содержащие в своем составе сложные ионы, существующие и в кристалле этого вещества, и в его растворе.
Комплексное соединение состоит из внешней координационной сферы ивнутренней координационной сферы, являющейся сложным ионом, составленным из центральной частицы — комплексообразователя, — и окружающих его частиц, называемых лигандами.
Обычно комплексообразователь — положительно заряженный ион; лиганды — либо отрицательно заряженные ионы, либо нейтральные молекулы. Количество лигандов определяется координационным числом (обозначим n или к. ч.).
Заряд комплексного иона внутренней координационной сферы равен сумме зарядов всех частиц, входящих в сложный ион, заряд которого компенсируется зарядом частиц внешней координационной сферы.
Примеры
1. К3[Fe(CN)6] — гексацианоферрат (III) калия;
три иона калия — внешняя координационная сфера;
[Fe(CN)6]--- — комплексный ион (внутренняя координационная сфера);
Fe+++ — комплексообразователь;
CN- — анион синильной кислоты НCN, лиганд;
6 — координационное число (n = 6);
Заряд комплексного иона:
+3 – 6 = -3.
Три минуса компенсируются тремя плюсами ионов калия.
2. [Cu(NH3)4]SO4 — сульфат тетрамминмеди (II);
Cu++— комплексообразователь;
молекулы NH3 — лиганды;
n = 4;
[Cu(NH3)4]++ — комплексный ион с зарядом +2.
Комплексные ионы зачастую обладают большой устойчивостью, иначе комплексного соединения не образовалось бы. Однако в некоторой небольшой степени сложные ионы могут разлагаться на свои составные части, что определяется константой соответствующего равновесия, называемой константой нестойкости.
Пример
[Ag(NH3)2]Cl — хлорид диамминсеребра.
При растворении в воде очень легко происходит диссоциация этого вещества на внутреннюю и внешнюю координационные сферы:
[Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl-
Далее предположим диссоциацию, распад самого комплексного иона:
[Ag(NH3)2]+ Û Ag+ + 2NH3
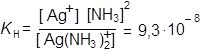 |
К Н — константа нестойкости.
Малое численное значение КН указывает на сильное смещение равновесия диссоциации комплексного иона в левую сторону, т. е. на прочность комплекса.
Ионы серебра могут образовывать комплексы и с разными лигандами, например: с ионами NО2-; ионами СN-; молекулами NH3 и др. Приведем значения К Н для этих комплексов:
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 602; Нарушение авторских прав?; Мы поможем в написании вашей работы!