
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства гидроксидов
|
|
|
|
1. При взаимодействии гидроксидов, растворимых в воде с кислотами, образуются соли и вода. Реакция взаимодействия гидроксида с кислотой называется реакцией нейтрализации, так как после ее окончания среда становится нейтральной.
2KOH + H2SO4 = K2SO4 + 2H2O
NaOH + HNO3 = NaNO3 + H2O
В ионной форме:
ОН– + Н+ = Н2О
2. Гидроксиды, растворимые в воде, взаимодействуют с кислотными оксидами. Например:
Ba(OH)2 + CO2 = BaCO3¯ + H2O
3. Гидроксиды, растворимые в воде, взаимодействуют с растворами различных солей. Например:
Cu(NO3)2 + 2NaOH = Cu(OH)2¯ + 2NaNO3
Al2(SO4)3 + 6KOH = 2Al(OH)3¯ + 3K2SO4
CrCl3 + 3NaOH = Cr(OH)3¯ + 3NaCl
В ионной форме:
Cu2+ + 2OH– = Cu(OH)2
Cr3+ + 3OH– = Cr(OH)3
К амфотерным гидроксидам относятся: Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Pb(OH)2, Sn(OH)2, Fe(OH)3 и др.
В зависимости от условий амфотерные гидроксиды могут выступать как в роли основания, так и в роли кислоты. Например:
¯Al(OH)3 + 3HCl = AlCl3 + 3H2O
Гидроксид алюминия в данном случае выступает в роли основания
При взаимодействии образуется ортоалюминат натрия
¯Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O
3. Кислоты – это электролиты, при диссоциации которых в водных растворах образуют ионы водорода.
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Многоосновные кислоты диссоцируют ступенчато. Например:
H2SO4 «2H+ + 
 «H+ +
«H+ + 
Растворы кислот имеют кислый вкус, разъедают кожу, ткань. Все кислоты изменяют цвет лакмуса на красный, метилоранжа на розовый.
Соли – электролиты, при диссоциации которых образуются катионы металлов (или ионы аммония 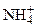 ) и анионы кислотных остатков.
) и анионы кислотных остатков.
В зависимости от состава различают следующие типы солей: средние, кислые, основные.
Средние соли следует рассматривать как продукты полного замещения атомов водорода кислоты металлом.
Н3РО4 + КОН = К3РО4 + 3Н2О
Образуется средняя соль К3РО4, которая диссоциирует
К3РО4 «3К+ + 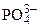
Кислые соли – продукты частичного замещения атома водорода кислоты металлом. Например:
H2SO4 + NaOH = NaHSO4 + H2O
В растворах кислые соли диссоциируют так:
NaHSO4 «Na+ + 
KH2PO4 «K+ + H2 
NaHS «Na+ + HS–
Ступенчатая диссоциация протекает так:
H2SO4 «H+ + 
 «H+ +
«H+ + 
H3  «H+ + H2
«H+ + H2 
H2  «H+ + H
«H+ + H 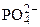
H 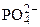 «H+ +
«H+ + 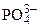
Одноосновные кислоты образуют одну соль, среднюю.
Многоосновные кислоты образуют, например, H2SO4 два вида солей: одну кислую и одну среднюю.
Основные соли получают таким путем:
Cu(OH)2 + HCl = CuOHCl + H2O
Al(OH)3 + HNO3 = Al(OH)2NO3 + H2O
Al(OH)3 + 2HNO3 = AlOH(NO3)2 + 2H2O
Fe(OH)3 + H2SO4 = FeOHSO4 + 2H2O
Итак, основные соли – продукты частичного замещения гидроксогрупп в молекуле основания на кислотные остатки кислоты.
В водных растворах основные соли диссоциируют таким образом:
CuOHCl «CuOH+ + Cl–
AlOH(NO3)2 «AlOH2+ + 2 
Ступенчатая диссоциация такова:
AlOHSO4 «AlOH2+ + 
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 726; Нарушение авторских прав?; Мы поможем в написании вашей работы!