
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон объемных отношений. Закон Авогадро
|
|
|
|
Закон постоянства состава
Закон сохранения массы вещества
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Ломоносов создал при Академии наук химическую лабораторию. В ней он изучал протекание химических реакций, взвешивая исходные вещества и продукты реакции. При этом он установил закон сохранения массы веществ.
Читается закон таким образом: масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Ломоносов впервые сформулировал этот закон в 1748 г, а экспериментально подтвердил его на примере сжигания металлов в запаянных сосудах в 1756 г. Несколько позднее (1789 г.) – закон сохранения массы был независимо от Ломоносова установлен французским химиком Лавуазье, который показал, что при химических реакциях сохраняется не только общая масса вещества, но и масса каждого из элементов, входящих в состав взаимодействующих веществ.
В результате установления закона в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава.
Читается закон постоянства состава так: каждое химическое соединение имеет постоянный состав независимо от способа его получения, т.е. всегда состоит из одних и тех же элементов, соединенных друг с другом в строго определенном отношении. Так, например, каким бы путем ни получали воду, в ее состав всегда входит водород и кислород в постоянном весовом отношении 1:8.
а) 2Н2 + О2 = 2Н2О б) НCl + NaOH = NaCl + H2O
Многие элементы, соединяясь друг с другом, могут образовать разные вещества, каждое из которых характеризуется определенным соотношением между массами этих элементов. Так, углерод образует с кислородом два соединения. Один из них – оксид углерода (II), содержит 42,88% (масс.) углерода и 57,12% (масс.) кислорода.
Второе соединение – диоксид углерода (IV) – содержит 27.29% (масс.) углерода и 72,71% (масс.) кислорода. Изучая подобные соединения Дальтон (английский ученый), в 1803г. установил закон кратных отношений. Читается этот закон так: если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящихся в этих соединениях на одну и ту же массу другого, относится между собой как небольшие целые числа.
|
Итак: на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (II).
Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Измеряя объемы газов, вступающих в реакцию, и образующихся в результате реакции Гей-Люссак пришел к обобщению, известному под названием закона простых объемных отношений.
Читается закон так: объемы вступающих реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
В 1811 г. итальянский физик Авогадро объяснил простые отношения между объемами газов, наблюдающиеся при химических реакциях, установил закон:
В равных объемах любых газов, взятых при одной и той же температуре, и при одинаковом давлении, содержится одно и то же число молекул.
С точки зрения этой гипотезы, хорошо объяснялись экспериментальные факты. Так, два объема хлористого водорода из одного объема хлора и одного объема водорода могут получиться только в том случае, если молекулы водорода и хлора «раскалываются» пополам, давая начало двум новым молекулам, следовательно, молекулы водорода и хлора должны состоять из нескольких атомов, число их должно быть четным и минимальное – 2
Н2 + Cl2 = 2НCl
В моле любого вещества число молекул равно 6,02·1023. Оно носит название числа Авогадро и обозначается буквой N. Из законов объемных отношений Гей-Люссака и Авогадро вытекают важные следствия.
1. Объем 1 моля любого газа при нормальных условиях занимает объем 22,4 л. Пользуясь этой величиной, можно вычислить массу заданного объема газа. При этом должны быть известны температура и давление заданного объема или массы газа. Вычисления могут быть сделаны как с помощью обычных пропорций, так и на основе уравнения Клапейрона-Менделеева:
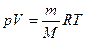 ,
,
где  – давление, объем, заданная масса, молекулярная масса; M и Т – абсолютная температура газа; R –универсальная газовая постоянная. Итак:
– давление, объем, заданная масса, молекулярная масса; M и Т – абсолютная температура газа; R –универсальная газовая постоянная. Итак:
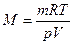 .
.
Литература:
1. Диккерсон Р., Грей Г., Хейт Дж. Основные законы химии.- М: Мир, 1982.- Т.1.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 1495; Нарушение авторских прав?; Мы поможем в написании вашей работы!