
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водородный показатель
|
|
|
|
Запись [H+] >7 или [H+] < 7 или [OH–] >10–7 либо [OH–] <10–7 неудобна, поэтому пользуются водородным или гидроксильным показателем среды.
Водородный показатель (обозначение рН) – это отрицательный десятичный логарифм концентраций ионов водорода
pH = –lg[H+]
Гидроксильный показатель (обозначение рОН) – это отрицательный десятичный логарифм концентраций гидроксид-ионов
pОH = –lg[ОH–]
Итак: рН + рОН = 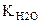 при t = 250C, рН + рОН =14.
при t = 250C, рН + рОН =14.
Величина рН (рОН) используется как мера кислотности, основности или нейтральности водных растворов.
рН< 7 – реакция среды кислая;
рН >7 – реакция среды щелочная;
рН = 7 – реакция среды нейтральная.
Более точные значения рН растворов могут быть определены только электрохимическим путем. Менее точно определены рН среды кислотно - основными индикаторами.
Гидролиз – это реакции обменного разложения вещества водой. Гидролиз солей происходит в тех случаях, когда ионы, образующиеся при электролитической диссоциации соли (катионы, анионы или оба вместе) способны образовывать с ионами воды (Н+ или ОН–) малодиссоциированные соединения. При гидролизе реакции среды становится либо кислой, либо щелочной. Гидролизу подвергаются соли, образованные слабыми кислотами и сильными основаниями, либо сильными кислотами и слабыми основаниями.
Например: гидролиз соли Cu(NO3)2. Вначале необходимо определить силу кислоты и силу гидроксида (основания). Основание слабое (Cu(OH)2), кислота HNO3 – сильная.
Решение. При растворении соли Cu(NO3)2 в воде диссоциирует:
Cu(NO3)2 «Cu2+ + 2 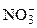
При составлении уравнения гидролиза, в первую очередь, необходимо определить ионы соли, которые свяжут ионы воды, (Н+ или ОН–) в малодиссоциирующее соединение, т.е. ионы, определяющие гидролиз.
Практически гидролиз соли протекает по первой ступени:
Cu(NO3)2 + НОН «HNO3 + CuOHNO3
Cu2+ + 2 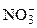 + HOH «CH3COOH + Na+ + OH–
+ HOH «CH3COOH + Na+ + OH–
CH3COO– + HOH «CH3COOH + OH–
Итак, растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию среды.
Рассмотрим случай гидролиза, когда соль образована слабой кислотой и слабым основанием. Гидролиз таких солей протекает следующим образом:
NH4CN + HOH «NH4OH + HCN
В результате гидролиза образуются слабо диссоциирующие вещества. Реакция среды будет нейтральной.
Количественной характеристикой гидролиза является степень гидролиза – это доля вещества, подвергающегося гидролизу. Степень гидролиза зависит от константы этого равновесия, а также от температуры и от концентрации соли. Уравнение реакции гидролиза пишем в общем виде так:
МА + НОН «МОН + НА  .
.
Концентрация воды в разбавленных растворах представляет собой практически постоянную величину. Обозначая К[H2O] = Kг, тогда
 .
.
Величина Кг называется константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу, чем больше Кг, тем в большей степени (при одинаковой температуре и концентрации соли) протекает гидролиз.
Для случая соли, образованной слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации Ккисл зависимостью:
 .
.
Это уравнение показывает, что Кг тем больше, чем меньше Ккисл, т.е. чем слабее кислота, тем в большей степени подвергается ее соль гидролизу. Для солей, образованных слабым основанием и сильной кислотой, Кг определяется следующим образом:
 .
.
Вывод отсюда таков: чем слабее основание, тем в большей степени подвергается гидролизу образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации кислоты и основания следующим соотношением:
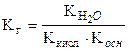 .
.
Степень гидролиза зависит от температуры, это вытекает из принципа Ле Шателье. Для ослабления гидролиза раствора следует хранить его концентрированным и при низких температурах. При повышении температуры степень гидролиза увеличивается.
Подавлению гидролиза способствует подкисление (в случае солей, образованных сильной кислотой и слабым основанием) или подщелачивание (для солей, образованных сильным основанием и слабой кислотой) раствора.
Плакат, где показано математическое выражение степени гидролиза и константы гидролиза.
Схемы гидролиза, образованных разными силами кислот и гидроксидов.
Литература:
1. Зайцев О.С. Общая химия. Направление и скорость химических процессов.– М.: Химия, 1983.
2. Глинка П.Л Общая химия.– Л.: Химия, 1984.
Лекция №11. Гидролиз солей
План лекции
1. Растворимость, произведение растворимости.
2. Константа и степень гидролиза.
3. Обратимый и необратимый гидролиз.
Ионное произведение воды. Вода – слабый электролит, поэтому молекулы ее в небольшой степени диссоциируют на ионы
 |
Свободные ионы водорода не способны к существованию в водном растворе, они мгновенно гидратируются до катионов оксония
 |
Ионное произведение воды (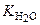 ) – это произведение молярных концентраций ионов Н+ и ОН– в воде и разбавленных водных растворах (T = const):
) – это произведение молярных концентраций ионов Н+ и ОН– в воде и разбавленных водных растворах (T = const):
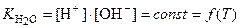
Применяя закон действия масс к диссоциации воды, имеем
Изменив концентрацию ионов водорода, а отсюда естественно и концентрцию гидроксид-ионов приводит к увеличению кислотности или щелочности раствора.
в кислой среде  моль/л;
моль/л;  моль/л;
моль/л;
в щелочной среде  моль/л;
моль/л;
в нейтральной среде  моль/л.
моль/л.
При расчетах вместо значений [H+] и [OH–] используют понятия водородный и гидроксильный показатель среды.
Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода: pH = –lg[H+].
Гидроксильный показатель (рОН) – это отрицательный десятичный логарифм концентрации ионов водорода: pОH = –lg[ОH–].
Величина рН (рОН) используется как мера кислотности, основности или нейтральности водных растворов:
pH< 7 – реакция среды кислая;
pH >7 – реакция среды щелочная;
pH = 7 –реакция среды нейтральная.
Значение рН растворов могут быть точно определены только электрохимическим путем. Для менее точной оценки используют кислотно-основные индикаторы.
Растворение многих веществ часто сопровождается химическим взаимодействием их с растворителем. Реакции взаимодействия между составными частями молекул растворителя и растворенного вещества называются сольволизом (для воды – гидролизом).
Гидролизом называется взаимодействия вещества с водой, при котором составные части вещества соединяются с составными частями воды. Гидролиз солей происходит в тех случаях, когда из ионов соли и ионов воды может образоваться хотя бы одно слабодиссоциирующее или плохо растворимое вещество.
В результате гидролиза растворы солей имеют либо кислую, либо нейтральную, либо щелочную реакцию.
Гидролизу подвергаются соли, образованные: слабыми кислотами и сильными основаниями; слабыми основаниями и сильными кислотами; слабыми кислотами и слабыми основаниями.
Гидролиз солей бывает обратимый, совместный и необратимый.
При гидролизе соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли, при этом в растворе возрастает концентрация ионов водорода, и он приобретает кислую реакцию, например:
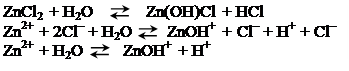
Гидролиз соли, образованной слабой кислотой НА и сильным основанием, характеризуется константой гидролиза КГ.
Количественной мерой способности солей гидролизоваться служит константа гидролиза, которая имеет общий вид
 .
.
Степень гидролиза (h) – это отношение количества молекул соли, подвергшихся гидролизу п, к общему количеству растворенной соли
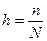 .
.
Степень гидролиза связана с константой гидролиза соотношением
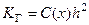 ;
; 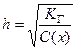 .
.
На процесс гидролиза оказывает влияние следующие факторы: температура (с повышением температуры степень гидролиза растет) и концентрация раствора (с разбавлением раствора степень гидролиза возрастает).
Литература:
1. Шрайвер Д. Неорганическая химия. -М.: Мир, 2004.- 486 с.
2. Глинка П.Л Общая химия.– Л.: Химия, 1984.
Лекция №12
Окислительно-восстановительные реакции
План лекции
1. Сущность окислительно-восстановительных реакций.
2. Методы составления уравнений окислительно- восстановительных реакций.
3. Метод электронного баланса, метод ионных полуреакций.
Окислительно-восстановительными реакциями называются реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ. Изменение степени окисления связано с переходом электронов или смещением электронных пар к наиболее электроотрицательному атому. Атомы, молекулы или ионы, отдающие электроны называются восстановителями, процесс отдачи электронов – окисление. Восстановитель, отдавая электроны, окисляется (степень окисления возрастает). Атомы, молекулы или ионы, принимающие электроны, называются окислителями, процесс – восстановление. Окислитель, присоединяя электроны, восстанавливается (степень окисления понижается).
К типичным окислителям относятся О2, галогены (F2, Cl2, Br2 J2), ионы металлов (Au3+, Fe3+, Ag+). Некоторые вещества, которые содержат в своем составе атомы в высших степенях окисления
|
и потому способны только понижать свою степень окисления.
К типичным восстановителям относятся металлы (Fe, Zn, Al и др.), водород Н2, углерод С, а также ряд соединений, содержащих в своем составе атомы с отрицательной степенью окисления (HCl–, HBr–, HJ–, H2S–2).
Вещества, содержащие в своем составе атомы с промежуточной степенью окисления способны как повышать, так и понижать степень окисления, т.е. могут выполнять функцию, как восстановителя, так и окислителя в зависимости от компонента реакции (H+3NO2,  SO3, +4MnO2, Sn+2Cl2, Fe+2SO4).
SO3, +4MnO2, Sn+2Cl2, Fe+2SO4).
Типы окислительно-восстановительных реакций:
1) межмолекулярные окислительно-восстановительные реакции, например
 SO3 + H2S–2 = 3S0 + 3H2O
SO3 + H2S–2 = 3S0 + 3H2O
2) межатомное и межмолекулярное окисление-восстановление
Cu+2SO4 + Fe0 = Fe+2SO4 + Cu0
3) реакции самоокисления-самовосстановления, например
3  MnO4 + 2H2O = 2K+7MnO4 + +4MnO2 + 4KOH
MnO4 + 2H2O = 2K+7MnO4 + +4MnO2 + 4KOH
4) реакции внутримолекулярного окисления-восстановления, например
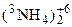 )Cr2O7 =
)Cr2O7 = 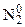 + +3Cr2O3 + 4H2O
+ +3Cr2O3 + 4H2O
Существует два метода подбора коэффициентов в уравнениях окислительно-восстановительных реакций. Метод электронного баланса, основанный на сравнении степеней окисления атомов элементов до и после реакции, например:
4Al0 + 3 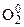 = 2
= 2 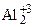
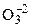
(вос-ль) 2Al0 – 6  = 2Al+3 (ок-ие)
= 2Al+3 (ок-ие)
(ок-ль) 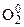 + 4
+ 4  = 2O–2 (вос-ие)
= 2O–2 (вос-ие)
Число отданных электронов восстановителем, должно равняться числу принятых электронов окислителем.
Второй метод – метод электронно-ионных уравнений. Его используют при составлении уравнений окислительно-восстановительных реакций, протекающих в растворах. При использовании этого метода степени окисления не определяют, а рассматривают ионы и молекулы окислителя или восстановителя и продуктов реакций в том виде, в каком они существуют в растворе. При этом слабые электролиты или малорастворимые вещества записывают в виде молекул, а сильные – в виде ионов.
По электронно-ионному методу составляют полуреакции для процессов окисления и восстановления с последующим суммированием их в общее уравнение
KMnO4 + H2SO4 + Na2SO3 = MnSO4 + Na2SO4 + K2SO4 + H2O
Литература:
1. Кубасов В.Л., Зарецкий С.А. Основы электрохимии.- М.: Химия, 1988.
2. Глинка П.Л Общая химия.– Л.: Химия, 1984.
Лекция №13. Электрохимические процессы
План лекции
1. Классификация электрохимических процессов.
2. Электродные потенциалы металлов.
3. Уравнение Нернста.
4. Электролиз. Катодные процессы.
5. Законы Фарадея.
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или через расплав электролита. На катоде (отрицательном электроде) происходит процесс восстановления, а на аноде (положительном электроде) – процесс окисления.
При электролизе разбавленных водных растворов катодные процессы будут определяться электродным потенциалом катиона, который необходимо сравнивать с потенциалом восстановления ионов водорода из воды (-0,41В).
Катодные процессы: на катоде в первую очередь будут восстанавливаться частицы, имеющие наиболее положительный электродный потенциал:
1) ионы металлов, потенциал которых значительно меньше этого значения, восстанавливаться не будут; на катоде будет выделяться водород из воды:
2Н2О +2  ®
®  + 2ОН–
+ 2ОН–
2) ионы металлов, потенциал которых значительно выше этого значения, будут восстанавливаться на катоде:
Meп+ + п  ® Ме0
® Ме0
3) при значениях потенциала металла, близких к -0,41В, на катоде происходит восстановление как ионов водорода из воды, так и ионов металла. Следовательно, чем больше электродный потенциал металла, тем легче восстанавливаются его ионы.
Анодные процессы: на аноде в первую очередь будут окисляться частицы, имеющие наименее положительный электродный потенциал. При этом надо учесть, что характер реакции, протекающей на аноде, зависит также и от материала, из которого сделан анод. Аноды подразделяют на нерастворимые (инертный анод) и растворимые (активный анод). Первые изготавливают из графита, платины, иридия: вторые – из меди, серебра, цинка, кадмия, никеля и других металлов.
В случае с нерастворимым анодом возможны два варианта:
1. анионы кислородных кислот и их солей ( ,
, 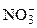 ,
,  ,
,  ) не окисляются на аноде. Вместо них окисляются ионы ОН– или (Н2О) с выделением кислорода:
) не окисляются на аноде. Вместо них окисляются ионы ОН– или (Н2О) с выделением кислорода:
4ОН– – 4  ® О2 + 2Н2О или 2Н2О – 4
® О2 + 2Н2О или 2Н2О – 4  ® О2+ 4ОН+
® О2+ 4ОН+
Например, из ионов  и ОН– окислятся на аноде будут ионы ОН–, так как
и ОН– окислятся на аноде будут ионы ОН–, так как 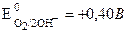 ;
; 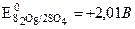 ;
;
4ОН– – 4  ® О2 + 2Н2О
® О2 + 2Н2О
2. анионы бескислородных кислот (S2–, J–,Cl–, Br– и др.) легко окисляются на аноде с выделением соответствующего элемента (S, J2,Сl2), а ионы ОН– (Н2O) в процессе не участвуют
Аnn– – n  ®Аn
®Аn
Например, из ионов J– и молекул Н2O окисляться на аноде будут ионы J– так как  (в кислой среде)
(в кислой среде)
2J– – 2  ® J2
® J2
В случае с растворимым анодом сам материал подвергается окислению, отдавая свои электроны во внешнюю цепь, и переходит в виде катионов в раствор. В результате этого анод растворяется:
металл анода Me – n  ® Меn+ (переходит в раствор)
® Меn+ (переходит в раствор)
Анионы электролита и гидроксид-ионы ОН– (или Н2O) в процессе не участвуют.
Например, из частиц J– и молекул Н2O и Cu (анод) подвергаться окислению будет материал анода (Cu), так как 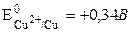 менее положителен, чем
менее положителен, чем  и
и  :
:
Cu0 –2  ® Cu2+
® Cu2+
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 4710; Нарушение авторских прав?; Мы поможем в написании вашей работы!