
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекции 1 страница
|
|
|
|
Химический эквивалент
Лекция №3
1. Эквивалент элемента.
2. Фактор эквивалентности.
3. Число эквивалентности вещества.
4. Молярная масса эквивалента вещества.
Эквивалент элемента – это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции одному электрону.
Фактор эквивалентности  – число, показывающее, какая доля реальной частицы вещества Х эквивалента одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции
– число, показывающее, какая доля реальной частицы вещества Х эквивалента одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции
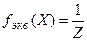 ,
,
где 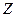 – абсолютное значение степени окисления элемента или число электронов, перешедших от восстановителя к окислителю. Фактор эквивалентности может быть равен или меньше единицы.
– абсолютное значение степени окисления элемента или число электронов, перешедших от восстановителя к окислителю. Фактор эквивалентности может быть равен или меньше единицы.
Например, 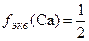 ,
,  ,
, 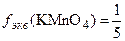 в кислой среде.
в кислой среде.
Масса одного моля эквивалента вещества Х, равная произведению фактора эквивалентности на молярную массу вещества Х, называется молярной массой эквивалента.
Согласно закону эквивалентов массы реагирующих веществ относятся между собой как их молярные массы эквивалентов.
Вычисление молярных масс эквивалентов кислот, гидроксидов и солей осуществляется следующим образом. Молярная масса эквивалента кислот определяется делением ее молекулярной массы на основность кислоты, т.е. на число атомов водорода, содержащихся в молекуле кислоты, способных замещаться на металл.
Молярная масса эквивалента соли вычисляется делением молекулярной массы соли, деленной на произведение числа ионов металла и его заряда, образующихся при диссоциации водных растворов солей.
Например:
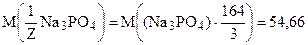 г/моль;
г/моль;
 г/моль;
г/моль;
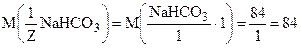 г/моль;
г/моль;
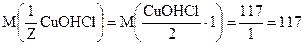 г/моль.
г/моль.
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы изотопа углерода –12.
 г,
г,
где 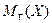 – относительная молекулярная масса вещества X,
– относительная молекулярная масса вещества X, 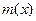 – масса молекулы Х,
– масса молекулы Х,  – масса атома углерода. Например,
– масса атома углерода. Например,
 .
.
Для количественных расчетов, участвующих в реакции веществ за единицу измерения количество вещества (п) принять моль.
Моль – количество вещества, содержащее 6,02×1023 молекул, атомов или других частиц. Число NA = 6,02×1023 моль–1 названо постоянной Авогадро (в честь итальянского ученого физика А.Авогадро).
Таким образом, один моль любого вещества в газообразном, жидком или твердом состоянии содержит число структурных частиц, равных 6,02×1023. Молярная масса вещества (М) – масса 1 моль вещества. Она численно равна относительной молекулярной массе. Например, Mг(H2S04) = 98 г/моль.
Молярную массу газа можно рассчитать: 1) по относительной плотности газа по воздуху: М = 29× 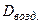
2) по молярному объему газа;
3) по уравнению Менделеева-Клапейрона
 ,
,
где р – давление газа; V – его объем, т – масса газа; М – молярная масса; Т – абсолютная температура; 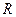 – универсальная газовая постоянная, равная 8,314 Дж/(моль×К) или 8,314 кПа×л/(моль×К).
– универсальная газовая постоянная, равная 8,314 Дж/(моль×К) или 8,314 кПа×л/(моль×К).
Количество эквивалентов вещества (число эквивалентности вещества)– это отношение массы вещества к молярной массе эквивалента вещества
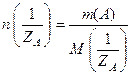 ,
,
где  – количество эквивалентов вещества.
– количество эквивалентов вещества.
Закон эквивалентов (В.Рихтер, 1791 г.): массы (объемы) реагирующих веществ пропорциональны молярным массам (объемам) их эквивалентов:
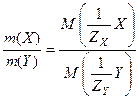 ;
; 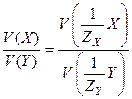 .
.
Литература:
1. Шретер В., Лаутеншелегер К.-Х., Бибак X. и др. Химия.-М.: Химия, 1989.
2. Кубасов В.Л., Зарецкий С.А. Основы электрохимии.- М.: Химия, 1988.
Лекция №4
Строение атома и систематика химических элементов
План лекции
1. Квантовая механическая модель атома. Квантовые числа.
2. Атомные орбитали. Принцип Паули, правило Гунда.
3. Строение многоэлектронных атомов. Правило Клечковского.
Атом представляет собой сложную микросистему, состоящую из ядра и движущихся вокруг него электронов. Все атомы состоят из фундаментальных частиц – протонов (р+), нейтронов (п 0) и электронов (е–).
Основными характеристиками атома являются заряд его ядра и массовое число.
Заряд ядра определяется числом протонов, массовое число – суммой протонов и нейтронов.
Количество электронов в атоме равно заряду его ядра. Характеристика состояния электронов в атомах основана на положении квантовой механики о двойственной природе электрона, обладающего одновременно свойствами частицы и волны.
Наиболее важной характеристикой атома является его атомный (порядковый) номер Z, равный числу протонов в ядре и, следовательно, числу электронов. Определить траекторию движения электрона, его координаты и скорость в данный момент невозможно. Для описания его движения вокругядра используется волновая функция y(х,у,z), где х,у,z – пространственные координаты.
Часть внутриатомного пространства, в которой движется электрон, называется электронным облаком. Плотность электронного облака в различных точках определяется вероятностью пребывания электрона.
Пространство, в котором наиболее вероятно нахождение электрона, называют орбиталью.
Энергетическое состояние электрона в изолированном атоме описывается четырьмя квантовыми числами: главным (п), орбитальным (ℓ), магнитным (т), спиновым (s).
1. п (главное квантовое число) – характеризует энергетический уровень атомной орбитали;
2. ℓ (орбитальное квантовое число) – определяет энергетический подуровень, а также форму атомной орбитали;
3. т (магнитное квантовое число) – определяет ориентацию атомной орбитали в пространстве;
4. s (спиновое квантовое число) – определяет вращение электрона вокруг собственной оси.
Каждая атомная орбиталь (АО) характеризуется определенным распределением в пространстве волновой функции y, квадрат которой определяет вероятность обнаружения электрона в соответствующей области пространства. Атомные орбитали, которые отвечают значения ℓ, равные 0,1,2, и 3, называют соответственно s-, p-, d-, и f- орбиталями.
|
Правило Гунда: орбитали в пределах данного подуровня заполняются сначала по одному электрону с одинаковой ориентацией спинов; когда все орбитали данного подуровня заполнятся, происходит спаривание электронов.
Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по АО, при котором энергия атома минимальна. Поэтому АО заполняется в порядке последовательного возрастания их энергий, при этом не должен нарушаться принцип Паули.
Порядок заполнения электронами АО определяется правилами Клечковского, которые учитывают зависимость энергии орбитали от значений как главного (п), так и орбитального (ℓ) квантовых чисел.
Первое правило Клечковского: последовательность заполнения орбиталей происходит от орбиталей с меньшим значением суммы (п + ℓ) к орбиталям с большим значением этой суммы.
Второе правило Клечковского: при одинаковых значениях суммы (п + ℓ), в первую очередь происходит заполнение орбиталей с меньшими значениями п.
Атомы элементов обладают свойствами отдавать и присоединять электрон. Эти свойства характеризуют величины: энергия ионизации и энергия сродства к электрону.
Энергия ионизации (J) – это количество энергии, которое необходимо затратить для отрыва электрона от нейтрального атома с образованием положительно заряженного иона:

Энергия сродства к электрону (Е) – это количество энергии, которая выделяется или поглощается при присоединении электрона к нейтральному атому с образованием отрицательно заряженного иона:
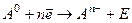
Мера энергии ионизации служит характеристикой металлических свойств элементов.
Мера энергии средства к электрону служит характеристикой неметаллических свойств элементов.
Литература:
1. Кубасов В.Л., Зарецкий С.А. Основы электрохимии.- М.: Химия, 1988.
2. Новиков Г.И. Основы общей химии. -М.: Высшая школа, 1988
Лекция №5. Химическая связь
План лекции
1. Основные типы и характеристики химической связи.
2. Ковалентная и ионная связи.
3. Основные виды взаимодействия молекул.
4. Комплексные соединения.
Переход вещества из атомарного (ионного) состояния в молекулярное обуславливается возникновением химической связи. Образование химической связи возможно в том случае, если это связано с выигрышем энергии.
Различают три основных типа химической связи: ковалентную, ионную и чисто ионную связь.
Ковалентная связь – химическая связь между двумя атомами, осуществляемая общей для этих атомов парой электронов (Н2, Cl2 и т.п.)
Ионная связь – результат электростатического взаимодействия противоположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками (Cs + F–, Na+ + Cl– и т.п.).
Чисто ионная связь представляет собой лишь предельный случай. В подавляющем большинстве связи имеют характер, промежуточный между чисто ковалентными и чисто ионными связями. Это полярные ковалентные связи, которые осуществляются общей для двух атомов парой электронов, смещенной к ядру одного из атомов-партнеров. Если такое смещение не велико, то связь по своему характеру приближается к чисто ковалентной; чем это смещение больше, тем ближе связь к чисто ионной.
Для оценки способности атома данного элемента оттягивать к себе электроны, осуществляющие связь, пользуются значением относительной электроотрицательности.
Для квантово-механического описания ковалентной связи и строения молекул могут быть применены два подхода: метод валентных связей и метод молекулярных орбиталей.
В основе метода валентных связей лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами, обладающими противоположно направленными спинами и принадлежащими двум атомам, между которыми осуществляется связь.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электроны облака. Поэтому ковалентная связь образуется в таком направлении, при котором это перекрывание максимально.
Электроотрицательность (ЭО) – способность атома в молекуле притягивать валентные электроны, связывающие его с другими атомами.
Механизмы образования ковалентной связи. Различают два механизма: обменный и донорно-акцепторный.
В обменном механизме для образования связи каждый атом представляет внешние неспаренные (валентные) электроны, которые занимают одну объединенную орбиту. Например: соединение двух атомов водорода с образованием молекулы водорода или атомов водорода с атомом кислорода, азота, фтора с образованием соответственно молекул воды, аммиака и фтороводорода. Все это изображается следующим образом:
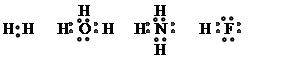 |
В донорно-акцепторном механизме в образовании связи участвуют атомы, которые не имеют неспаренных электронов, но имеют неподеленные пары электронов или свободные атомные орбитали. При этом атом, предоставляющий для образования связи неподеленную пару элементов, называется донором. Атом, который представляет свободную орбиталь – акцептором.
Многие молекулы сложных веществ, между атомами которых действуют ковалентные или ионные связи, способны участвовать в реакциях присоединения за счет образования связей по донорно-акцепторному механизму. Комплексными соединениями называют соединения, в узлах кристаллов которых находятся комплексные ионы, способные к самостоятельному существованию, как в твердом, так и в жидком состоянии, например, K4[Fe(CN)6]. Основные положения координационной теории, объясняющей строение комплексных соединений, заключается в следующем:
1) центральное место в химической частице комплексного соединения занимает атом-комплексообразователь (типичными комплексообразователями являются ионы и атомы d-металлов);
2) вокруг комплексообразователя расположены лиганды – простые или сложные ионы или молекулы. Число химических связей, устанавливаемых комплексообразователем с лигандами, называется координационным числом комплексообразователя;
3) комплексообразователь и лиганды образуют внутреннюю координационную сферу комплексного соединения (ион или молекула);
4) ионы, не входящие во внутреннюю сферу, составляют внешнюю сферу комплексного соединения. Внешняя сфера от внутренней отделяется квадратными скобками. Так, в комплексном соединении K3[Fe(CN)6] ион Fe3+ – комплексообразователь, ионы CN– лиганды, координационное число равно 6, [Fe(CN)6]3– – внутренняя сфера (комплексный ион), К+ – внешняя сфера.
Важнейшими лигандами являются:
1) отрицательно заряженные ионы: OH–, F–, Cl–, Br–, J–, CN–, SCN–, 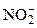 ,
,  ,
,  ,
,  и др.
и др.
2) нейтральные полярные молекулы: Н2О, NH3, NO, CO и др. Число химических связей, образуемых лигандами с комплексообразователем, определяют дентатность лиганды. Так, NH3 – монодентантный лиганд. Координационные числа для некоторых комплексообразователей приводятся ниже:
2 – Cu+, Ag+, Au+;
4 – Cu2+, Au3+, Zn2+, Cd2+, Hg2+, Pb2+, Pd2+, Pt2+;
6 – Zn2+, Al3+, Pb4+, Cr3+, Fe2+, Co2+, Co3+, Ni2+, Pt4+.
В зависимости от природы лигандов, комплексные соединения делят на следующие типы:
1) ацидокомплексы; лиганды - кислотные остатки.
Например, K4[Fe(CN)6], Na3[Ag(SO3)2];
2) гидроксокомплексы; лиганды-гидроксиданионы.
Например: K4[Au(OH)4], Na3[Al(OH)6];
3) аквакомплексы; лиганды-молекулы воды. Например, [Cr(H2O)6]Cl3; [Fe(H2O)6]Cl3.
4) аммиакаты; лиганды-молекулы аммиака. Например, [Cu(NH3)4]SO4; [Pt(NH3)6]Cl3.
В растворах комплексные соединения, содержащие комплексные ионы, диссоциируют как сильные электролиты, например:
[Ag(NH3)2]Cl «[Ag(NH3)2]+ + Cl–
K[Ag(CN)2]Cl «K+ + [Ag(CN)2]–
Комплексные ионы в растворе, в свою очередь, диссоциируют ступенчато, как слабые электролиты:
[Ag(NH3)2]+ «Ag+ + 2 
 .
.
Константу диссоциации комплексного иона называют константой нестойкости Кнест.. Она характеризует устойчивость комплексного иона. Для иона [Ag(NH3)2]+ константа нестойкости такова:
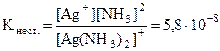 .
.
Чем меньше константа нестойкости, тем прочнее комплексный ион.
Литература:
1. Гельфман М.И. Химия. 2-ое издание. -М.: Лань, 2003.- 480 с.
2. Лидин Р.А. Задачи по общей химии. -М.: Владос, 2004. -383 с.
Лекция №6
Основные закономерности протекания химических процессов
План лекции
1. Энергетика химических процессов.
2. Внутренняя энергия и энтальпия.
3. Законы Гесса и следствия из него.
4. Энтропия, энергия Гиббса и их изменения при химических процессах.
Химические реакции протекают с выделением или с поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты. Так, горение, соединение металлов с серой или с хлором, нейтрализация кислот с щелочами сопровождаются выделением значительных количеств теплоты. Наоборот, такие реакции как разложение карбоната кальция, образование оксида азота из азота и кислорода требуют для своего протекания непрерывного притока теплоты извне и тотчас же приостанавливаются, если нагревание прекращается. Ясно, что эти энергии протекают с поглощением теплоты.
Выделение теплоты при взаимодействии различных веществ заставляет признать, что эти вещества еще до реакции в скрытой форме обладали определенной энергией. Такая форма энергии, скрытая в веществах и освобождающаяся при химических, а также при некоторых физических процессах (например, при конденсации пара в жидкость или при кристаллизации жидкости), называется внутренней энергией вещества.
При химических превращениях освобождается часть содержащейся в веществах энергии. Измеряя количество теплоты, выделяющееся при реакции (так называемый тепловой эффект реакции), мы можем судить об изменении этого запаса.
Тепловой эффект реакции – количество теплоты, выделяемое или поглощаемое в процессе реакции.
При химических реакциях происходит взаимное превращение внутренней энергии веществ с одной стороны, и тепловой, лучистой, электрической или механической энергии – с другой.
Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается – эндотермическими.
Раздел химии, посвященной количественному изучению тепловых эффектов реакции, получил название термохимии.
Результаты термохимических измерений – тепловые эффекты реакции – принято относить к одному молю образующегося вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ, называется теплотой образования (энтальпией, DН) данного соединения.
Химические уравнения, в которых указано количество выделяющейся или поглощаемой теплоты, называются термохимическими уравнениями.
При термохимических расчетах используется понятие теплоты образования – энтальпии. Теплота образования– это количество теплоты, выделяющееся или поглощающееся при образовании сложного вещества из простых веществ.
Тепловой эффект реакции, отнесенной к 1 молю вещества, устойчивого в стандартных условиях (Т = 298К, р = 101,3 кПа), называется стандартной энтальпией (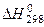 ). Единица измерения энтальпии – кДж/моль.
). Единица измерения энтальпии – кДж/моль.
Некоторые процессы протекают без изменения энергетического состояния системы и в этом случае для предсказания направления процесса недостаточно сведений об этих изменениях. Движущей силой таких процессов является тенденция перехода в более вероятное состояние, которое характеризуется возрастанием в системе беспорядка, хаоса.
Мерой неупорядоченности системы является энтропия (S). Энтропия не может быть отрицательной. Изменение энтропии (DS) веществ, участвующих в реакции, называют энтропией реакции.
Энтропия, отнесенная к 1 молю вещества при 298К и 101,3 кПа, называется стандартной энтропией ( ).
).
Наука о взаимных превращениях различных видов энергии называется термодинамикой. При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии, в большинстве случаев в виде теплоты.
Возможности и пределы самопроизвольного протекания реакции (р1Т = const) определяют с учетом энергии Гиббса (G):
G = Н – ТS.
Изменение энергии Гиббса (DG) в ходе реакции называют энергией Гиббса химической реакции или движущей силой процесса:
DG = DН – ТDS.
В стандартных условиях энергию Гиббса реакции обозначают как  . Единица измерения – кДж/моль.
. Единица измерения – кДж/моль.
Все термохимические расчеты основаны на законе Гесса. Тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции
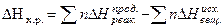
Уравнения реакции, в которых около символов химических соединении указывается их агрегатное состояние или кристаллическая модификация, а также числовые значения тепловых эффектов, называются термодинамическими. Мерой химического сродства является убыль G - потенциала или 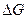 , которая зависит от природы вещества, его количества, температуры и является функцией состояния, т.е.
, которая зависит от природы вещества, его количества, температуры и является функцией состояния, т.е.
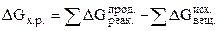
Самопроизвольно протекают процессы, идущие в сторону уменьшения G. При 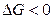 процесс принципиально осуществим, при
процесс принципиально осуществим, при 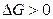 процесс самопроизвольно проходить не может. Чем меньше
процесс самопроизвольно проходить не может. Чем меньше  , тем сильнее стремление к протеканию данного процесса и тем дальше от состояния равновесия, при котором
, тем сильнее стремление к протеканию данного процесса и тем дальше от состояния равновесия, при котором 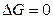 и
и 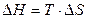 . Из соотношения
. Из соотношения 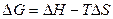 видно, что самопроизвольно могут протекать и процессы, для которых
видно, что самопроизвольно могут протекать и процессы, для которых  (эндотермические). Это возможно, когда
(эндотермические). Это возможно, когда 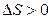 и
и 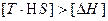 и тогда
и тогда 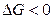 . С другой стороны, экзотермические реакции (
. С другой стороны, экзотермические реакции (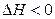 ) самопроизвольно не протекают, если при
) самопроизвольно не протекают, если при  окажется, что
окажется, что 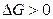 .
.
Литература:
1. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия.- М.: Химия, 1992.
Лекция №7. Химическая кинетика
План лекции
1. Скорость химических реакций (гомогенных и гетерогенных).
2. Закон действующих масс.
3. Влияние температуры на скорость химических реакций.
Химическая кинетика – это учение о скоростях химических реакций.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда – вещества, окружающие систему. Обычно система физически ограничена от среды.
Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной – система, состоящая из нескольких фаз.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Примером гомогенной системы может служить любая газовая смесь (все газы при не очень высоких давлениях неограниченно растворяются друг в друге), хотя бы смесь азота с кислородом.
В качестве примеров гетерогенных систем можно привести следующие системы: вода со льдом, насыщенный раствор с осадком, уголь и сера в атмосфере воздуха. В последнем случае система состоит из трех фаз: двух твердых и одной газовой.
При практическом использовании химических реакций весьма важно знать, с какой скоростью будет протекать данная реакция в тех или иных условиях, и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью.
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция.
Гомогенная реакция – это реакция, в которой реагенты в одном агрегатном состоянии, например:
N2(г) + 3H2(г) = 2NH3(г)
Гетерогенная реакция – это реакция, в которой реагенты находятся в разных агрегатных состояниях, например
С(т) + О2(г) = СО2(г)
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени. При V=const средняя скорость реакции рассчитывается по уравнению
vcp =  ,
,
где 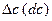 – изменение концентрации одного из реагирующих веществ, моль/л;
– изменение концентрации одного из реагирующих веществ, моль/л;  – отрезок времени, за который это изменение концентрации произошло, сек, мин.
– отрезок времени, за который это изменение концентрации произошло, сек, мин.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 568; Нарушение авторских прав?; Мы поможем в написании вашей работы!