
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекции 2 страница
|
|
|
|
Скорость гомогенной реакции определяется количеством вещества (п), вступившего в реакцию в единицу времени (t) в единице объема (V) системы:
vгомог = 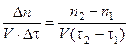 .
.
Единица измерения скорости гомогенной реакции – моль/(л×с). Приняв, что 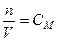 (молярная концентрация), уравнение можно преобразовать к виду:
(молярная концентрация), уравнение можно преобразовать к виду:
vгомог = 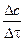 .
.
Скорость гетерогенной реакции определяется количеством вещества (п), вступившего в реакцию за единицу времени (t) на единице площади поверхности (S) фазы:
vгетер = 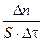 ,
,
S – площадь поверхности фазы.
Зависимость скорости реакции от концентрации веществ выражается законом действия масс (закон Гульдберга и П.Вааге).
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрация входит в произведение в степени, равной коэффициенту, стоящему перед формулой данного вещества в уравнении реакции
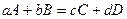 ,
,
математическое выражение закона действия масс имеет вид:
v = 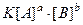 ,
,
где 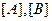 – молярные концентрации веществ А и В, моль/л; а и b – стехиометрические коэффициенты в уравнении; К – константа скорости реакции.
– молярные концентрации веществ А и В, моль/л; а и b – стехиометрические коэффициенты в уравнении; К – константа скорости реакции.
Значение константы скорости реакции зависит от природы веществ и от температуры: чем больше значение К, тем быстрее идет реакция v = К.
Закон действия масс справедлив только для веществ, находящихся в газообразном состоянии (для гомогенных реакций). Например, для реакции
2NО(г) + О2 = 2NО2(г)
в соответствии с законом действия масс скорость реакции выражается уравнением
v = К[NO]2 × [O2].
Так как скорость гетерогенной реакции зависит не только от концентрации веществ, но и от величины площади поверхности твердой фазы, то, чем больше степень измельчения твердого вещества, тем быстрее протекает реакция (при этом концентрация твердого вещества не изменяется). Например, для реакции
|
|
|
С(т) + О2(г) = СО2(г)
закон действия масс может быть записать
v = К[O2]×S.
Зависимость скорости реакции от температуры выражается уравнением Аррениуса
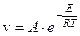 ,
,
где: А – постоянная для данной реакции множитель; R – универсальная газовая постоянная; Т – абсолютная температура; Е – энергия активации.
Энергия активации (Е) – это, то избыточное количество энергии, которой должны обладать молекулы реагирующих веществ в момент столкновения, чтобы произошла химическая реакция.
Для приближенных расчетов зависимость скорости реакции от температуры можно выразить законом Вант-Гоффа.
Повышение температуры на каждые 100 увеличивает скорость реакции в 2-4 раза. Математический закон Вант-Гоффа записывается следующим образом:
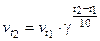 или
или 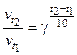 ,
,
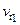 и
и 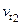 – скорость при начальной и конечной температурах (
– скорость при начальной и конечной температурах (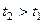 ); g – температурный коэффициент скорости реакции, показывает во сколько раз увеличится скорость реакции с изменением температуры.
); g – температурный коэффициент скорости реакции, показывает во сколько раз увеличится скорость реакции с изменением температуры.
Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость:
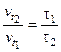 или
или 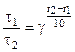 ,
,
где t1 и t2 – время протекания реакции при температурах t1 и t2.
Если говорить о влиянии катализатора на скорость реакции, дадим определение катализатору.
Катализаторы – это вещества, которые изменяют скорость реакции, но не входят в состав ее конечных продуктов.
Катализаторы уменьшают энергию активации, что приводит к значительному возрастанию скорости реакции.
Литература:
1. Гельфман М.И. Химия. 2-ое издание. -М.: Лань, 2003.- 480 с.
Лекция №8. Химическое равновесие
План лекции
1. Константа равновесия и ее связь с энергией Гиббса.
2. Смещение химического равновесия – принцип Ле-Шателье.
3. Факторы, влияющие на смещение равновесия.
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции.
|
|
|
Необратимые реакции – протекают до конца, до полного израсходования одного из реагирующих веществ.
Обратимые реакции – протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2# + 2H2O
При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении – пропускать двуокись азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится – данная реакция не может протекать в обратном направлении.
Таким образом, взаимодействие цинк с азотной кислотой – необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению
N2 + 3Н2 = 2NН3
Если смешать 1 грамм молекулу азота с тремя грамм-молекулами водорода, осуществить в системе условия, благоприятствующее протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород).
Если теперь в те же условия в качестве исходного вещества поместить не азотно-водородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количествами всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака – обратимая реакция.
В уравнениях обратимых реакций вместо знака равенства можно ставить стрелки; они символизируют протекание реакций, как в прямом, так и в обратном направлениях.
Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций участвующих в реакции веществ не происходит.
Химическое равновесие – это такое состояние, при котором скорость прямой реакции становится равной скорости обратной реакции.
|
|
|
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия.
Каждая обратимая химическая реакция, проводимая в определенных условиях, имеет присущее только ей положение химического равновесия, которое характеризуется по закону действия масс константой равновесия. Так для обратимой гомогенной реакции
N2(г) + 3H2(г) = 2NH3(г)
константа равновесия имеет вид
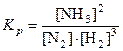 ,
,
Кр – константа равновесия, зависит от природы реагирующих веществ и температуры; 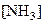 ,
, 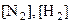 – равновесные концентрации реагирующих веществ и продуктов реакции; 2 и 3 – стехиометрические коэффициенты.
– равновесные концентрации реагирующих веществ и продуктов реакции; 2 и 3 – стехиометрические коэффициенты.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т.е. тем больше выход ее продуктов.
Принцип Ле-Шателье или смещение химического равновесия.
Нарушение равновесия вследствие увеличения (изменения) концентрации какого-либо из веществ, участвующих (в реакции) в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия.
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема системы).
Когда в реакции действуют газы, равновесие может нарушиться при изменении объема системы. Например,
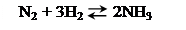 |
|
|
|
Не изменяя температуры, уменьшим в 2 раза объем системы.
Нетрудно заметить, что неодинаковое изменение скорости прямой и обратной реакций связано с тем, что в левой и правой частях уравнения рассматриваемой реакции различно число молекул газов: одна молекула азота и три молекулы водорода (всего четыре молекулы газов) превращаются в две молекулы аммиака. Давление газа есть результат ударов его молекул о стенки сосуда; при прочих равных условиях давление газа тем выше, чем больше молекул заключено в данном объеме газа. Поэтому реакция, протекающая с увеличением числа молекул газов, приводит к возрастанию давления, а реакция, протекающая с уменьшением числа молекул газов – к его понижению. Помня об этом, вывод о влиянии давления на химическое равновесие можно сформулировать так.
При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
При уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
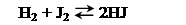 В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе
В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе
равновесие не нарушается при изменении объема: выход не зависит от давления.
При смещении положения химического равновесия в прямом направлении увеличивается выход продуктов, а при смещении в обратном направлении выход продуктов уменьшается.
При изменении внешних условий (концентрации, давления, температуры) в соответствии с принципом Ле-Шателье положение химического равновесия смещается в сторону реакции, которая противодействует производственному изменению.
а) Влияние изменения температуры на положение химического равновесия связано с тем, что при повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры химическое равновесие смещается в направлении экзотермической реакции.
б) Влияние концентрации реагирующих веществ на состояние химического равновесия связано с тем, что при повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
в) Влияние давления на положение равновесия подчиняется правилу: при повышении давления равновесие сдвигается в направлении образования веществ с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом.
Константа равновесия Кт химических реакций связана со стандартным изменением энергии Гиббса этой реакции 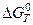 уравнением
уравнением
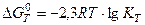 .
.
Из этого уравнения следует, что при Кт = 1 стандартная энергия Гиббса химической реакции равна нулю. Тогда из соотношения 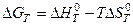 вытекает, что при соответствующей температуре
вытекает, что при соответствующей температуре 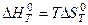 , откуда
, откуда 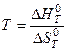 .
.
Литература:
1. Шрайвер Д. Неорганическая химия. -М.: Мир, 2004.- 486 с.
2. Зайцев О.С. Общая химия. Направление и скорость химических процессов.– М.: Химия, 1983.
Лекция №9. Растворы
План лекции
1. Тип растворов. Растворимость.
2. Растворы неэлектролитов и электролитов.
3. Закон Рауля, уравнение Ван-Гоффа.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут измениться в широких пределах. Наиболее важный вид раствора – жидкие растворы.
Всякий раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существуют в таком же агрегатном состоянии, что и полученный раствор.
Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Растворение кристалла в жидкости протекает следующим образом. Когда вносят кристалл в жидкость, в которой он может растворяться, от поверхности его отрываются отдельные молекулы. Последние, благодаря диффузии, распределяются по всему объему растворителя. Отделение молекул от поверхности твердого тела вызывается, с одной стороны, их собственным колебательным движением, а с другой – притяжением со стороны молекул растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс – кристаллизация. Пришедшие в раствор молекулы, ударяясь о поверхность еще нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
Важной характеристикой растворов является концентрация – это количество растворенного вещества в определенном объеме или в определенной массе раствора или растворителя.
Существует несколько способов выражения концентрации растворенного вещества в растворе. Рассмотрим некоторые из них.
Массовая доля вещества Х (w(х)) – показывает отношение массы растворенного вещества Х к массе раствора и выражается в процентах:
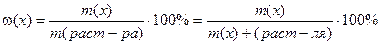
где т (х) – масса растворенного вещества Х, г.
Молярная концентрация вещества Х (С(х)) – показывает отношение количества растворенного вещества Х к объему раствора и выражается в моль/л:
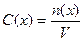 ,
,
где 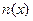 – количество растворенного вещества Х, моль.
– количество растворенного вещества Х, моль.
Зная, что 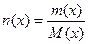 , можно представить так:
, можно представить так:
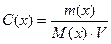 , моль/л.
, моль/л.
Молярная концентрация эквивалента вещества Х или эквивалентная (нормальная) концентрация 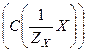 показывает отношение количества эквивалентов растворенного вещества к объему раствора и выражается в моль/л:
показывает отношение количества эквивалентов растворенного вещества к объему раствора и выражается в моль/л:
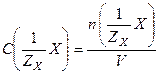 ,
,
где 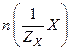 – количество эквивалентов растворенного вещества Х, моль.
– количество эквивалентов растворенного вещества Х, моль.
Для обозначения нормальной концентрации в лаборатории используют обозначение 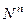 .
.
Литература:
1. Зайцев О.С. Общая химия. Состояние веществ и химических реакций.– М.: Химия, 1990.
2. Зайцев О.С. Общая химия. Направление и скорость химических процессов.– М.: Химия, 1983.
Лекция №10. Растворы электролитов
План лекции
1. Электролитическая диссоциация.
2. Сильные и слабые электролиты.
3. Водородный показатель среды.
Процесс распада вещества на ионы под действием растворителя (воды) называют электролитической диссоциацией. Следствием электролитической диссоциации является электрическая проводимость растворов электролитов.
По способности растворов веществ – проводить электрический ток их делят на электролиты и неэлектролиты.
К электролитам относятся соединения с ионной или ковалентно- полярной химической связью (кислоты, гидроксиды и соли).
Вещества, в молекулах которых имеется неполярная или малополярная химическая связь, называются неэлектролитами.
По относительной электролитической проводимости растворов можно судить о степени диссоциации электролита (а), которая показывает отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Электролиты, у которых a примерно равна единице, считаются сильными.
К сильным электролитам относят: из кислот все галогеноводородные (HCl, HBr, HI), кроме фтороводородной HF, серную, азотную, хлорную, из гидроксидов – все щелочи (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Ba(OH)2, Sr(OH)2) подавляющее число растворимых солей. К слабым электролитам относят: из кислот – угольную Н2СО3, сероводородную H2S, циановодородную НСN, уксусную СН3СООН, азотистую HNO2, хлорноватистую HClO и др; из гидроксидов – все нерастворимые в воде.
Многоосновные кислоты и многокислотные гидроксиды диссоциируют ступенчато:
Н3РО4 «Н+ + Н2 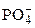
Н2 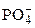 «Н+ +
«Н+ + 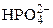
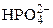 «Н+ +
«Н+ + 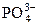
Cu(OH)2 «OH– + CuOH+
CuOH+ «OH– + Cu2+
Наибольшей степенью диссоциации характеризуется первая ступень.
Вода – малодиссоциированное вещество. Константа диссоциации воды равна
Н2О «Н+ + ОН– 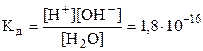 (при 220С).
(при 220С).
Молярная концентрация воды [H2O] составляет 1000/18 = 55,56 моль/л, откуда ионное произведение воды Кв = [H+]×[OH–] = Kд, [H2O] = 1,8×10–16×55,56 = 10–14 (при 220С).
Концентрация ионов Н+ и ОН– в нейтральном растворе равны между собой: [H+] = [OH–] = 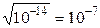 моль/л.
моль/л.
Количественно характер среды раствора определяется водородным показателем рН, который вычисляется через отрицательный десятичный логарифм от концентрации ионов водорода
рН = –Lg[H+]
Для нейтральных растворов рН равен 7, для кислых меньше 7, а для щелочных – больше 7. Характер среды раствора можно определять с помощью кислотно-основных индикаторов, меняющих свой цвет в зависимости от концентрации ионов водорода или гидроксид-ионов.
Каждый индикатор характеризуется определенными интервалами рН раствора, при которых он изменяет свой цвет: метилового оранжевого – от розового до желтого при рН от 3,1 до 4,4; фенолфталеина – от бесцветного до малинового при рН от 8,3 до 9,8. Изменение цвета лакмуса от красного до синего происходит при рН от 8,3 до 9,8. Эти интервалы значений рН называется областями перехода индикатора.
Изменение характера среды происходит не только в результате добавления к воде кислоты или щелочи, но и при растворении некоторых солей. Процесс обменного взаимодействия ионов соли с водой, который приводит к изменению среды раствора, называется гидролизом соли. Вследствие связывания ионов соли с ионами воды в малодиссоциированные соединения нарушается равновесие диссоциации воды в сторону ее усиления и накопления в растворе ионов водорода или гидроксид-ионов. При этом изменяется рН раствора.
Причиной гидролиза соли является наличие в ней ионов слабого электролита гидроксида или кислоты. Различают гидролиз соли по:
1) катиону (катион от слабого гидроксида);
2) аниону (анион от слабой кислоты);
3) катиону и аниону (оба от слабых электролитов).
В последнем случае гидролиз соли происходит наиболее сильно.
Соли, образованные многозарядным катионом или многозарядным анионом, гидролизуются ступенчато с образованием малодиссоцированных гидроксокатионов или гидроксоанионов. При комнатной температуре, как правило, гидролиз идет по первой ступени.
I. Гидролиз по катиону:
а) катион однозарядный:
NH4Cl «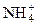 + Cl–
+ Cl–
NH4Cl + HOH «NH4OH +HCl
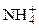 + Cl– + HOH «NH4OH + H+ + Cl–
+ Cl– + HOH «NH4OH + H+ + Cl–
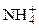 + HOH «
+ HOH «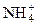 + H+
+ H+
б) катион многозарядный:
CuSO4 «Cu2+ + 
2CuSO4 + 2HOH «(CuOH)2SO4 +H2SO4 (1-ая ступень гидролиза)
2 Cu2+ + 2  + 2НОН «2CuOH+ +
+ 2НОН «2CuOH+ + 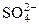 + 2H+ +
+ 2H+ + 
2 Cu2+ + 2HOH «2CuOH+ + 2H+
Гидролиз по катиону приводит к связыванию гидроксид-ионов воды и накоплению ионов водорода, среда кислая, рН<7.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 546; Нарушение авторских прав?; Мы поможем в написании вашей работы!