
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Описание изопроцессов в идеальных газах
В идеальных газах и круговых процессов в тепловых машинах
Применение термодинамических представлений к описанию изопроцессов
Определим изменение внутренней энергии, энтропии, теплоемкость идеального газа при сообщении ему некоторого количества тепла и совершении газом работы в изохорическом, изобарическом, изотермическом и адиабатическом процессах.
а). Рассмотрим изохорический процесс, при котором некоторой массе m идеального газа сообщается количество тепла  , так что объем газа остается постоянным
, так что объем газа остается постоянным 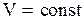 , а давление газа изменяется при этом от значения
, а давление газа изменяется при этом от значения  до значения
до значения  , температура - от
, температура - от 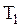 до
до 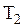 . Приращение внутренней энергии газа за процесс на основании (3.16) равно:
. Приращение внутренней энергии газа за процесс на основании (3.16) равно:
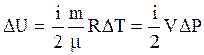 , (3.40)
, (3.40)
где  - число степеней свободы молекул,
- число степеней свободы молекул,  - молярная масса идеального газа,
- молярная масса идеального газа, 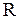 - молярная газовая постоянная.
- молярная газовая постоянная.
Согласно (3.29) работа, совершаемая в любом термодинамическом процессе, (3.29) равна 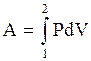 , но в изохорическом процессе
, но в изохорическом процессе 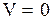 , следовательно, работа
, следовательно, работа  (3.41)
(3.41)
в изохорическом процессе не совершается.
На основании первого закона термодинамики (3.36) и (3.37), а также (3.40) и (3.41) количество тепла, сообщаемое газу в изохорическом процессе, равно изменению внутренней энергии его в этом процессе, т.е.
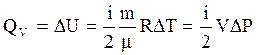 (3.42)
(3.42)
или в дифференциальной форме
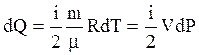 . (3.43)
. (3.43)
Молярная теплоемкость идеального газа в изохорическом процессе, согласно (3.31) и (3.43), равна: 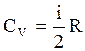 , (3.44)
, (3.44)
т.е. пропорциональна числу степеней свободы молекул газа и не зависит от температуры. Изменение энтропии в изохорическом процессе, исходя из (3.34) и (3.43), определится по формуле:
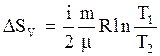 . (3.45)
. (3.45)
б). Рассмотрим изобарический процесс, при котором некоторой массе m идеального газа сообщается количество тепла  , так что давление газа остается постоянным
, так что давление газа остается постоянным 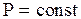 , а объем его изменяется от значения
, а объем его изменяется от значения 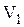 до значения
до значения 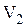 , температура - от
, температура - от 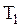 до
до 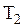 . Приращение внутренней энергии газа за процесс, согласно (3.16), равно:
. Приращение внутренней энергии газа за процесс, согласно (3.16), равно:
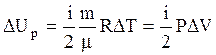 . (3.46)
. (3.46)
Исходя из (3.29), найдем работу газа в изобарическом процессе
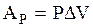 (3.47)
(3.47)
или определив 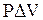 из (3.9) и подставляя в (3.47), имеем
из (3.9) и подставляя в (3.47), имеем
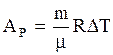 . (3.48)
. (3.48)
На основании первого закона термодинамики (3.36), (3.37), а также (3.46) и (3.47) или (3.48), количество тепла, сообщаемое газу в изобарическом процессе равно: 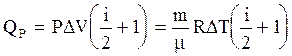 (3.49)
(3.49)
или в дифференциальной форме:
 . (3.50)
. (3.50)
Молярная теплоемкость идеального газа в изобарическом процессе, согласно (3.31) и (3.50), равна:  . (3.51)
. (3.51)
Из сравнения (3.45) и (3.51) видно, что
 , (3.52)
, (3.52)
т.е. молярная теплоемкость в изобарическом процессе больше молярной теплоемкости в изохорическом процессе на величину молярной газовой постоянной. Приращение энтропии в изобарическом процессе, исходя из (3.34) и (3.50), определяется по формуле:
 . (3.53)
. (3.53)
в). Рассмотрим изотермический процесс, при котором некоторой массе 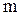 идеального газа сообщается количество тепла
идеального газа сообщается количество тепла  , так что температура газа остается постоянной
, так что температура газа остается постоянной 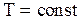 , а объем газа изменяется от значения
, а объем газа изменяется от значения 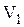 до значения
до значения 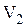 , давление - от
, давление - от  до
до  . Уравнение изотермы на основании (3.9) запишется в виде
. Уравнение изотермы на основании (3.9) запишется в виде
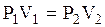 . (3.54)
. (3.54)
Приращение внутренней энергии за этот процесс, согласно (3.16) равно нулю
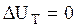 , (3.55)
, (3.55)
т.к. 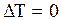 , следовательно в изотермическом процессе внутренняя энергия идеального газа не изменяется. Исходя из (3.29) и подставляя вместо
, следовательно в изотермическом процессе внутренняя энергия идеального газа не изменяется. Исходя из (3.29) и подставляя вместо 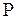 его выражение из (3.9), найдем работу газа в изотермическом процессе:
его выражение из (3.9), найдем работу газа в изотермическом процессе:
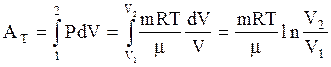 (3.56)
(3.56)
или с учетом (3.54):
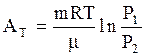 . (3.57)
. (3.57)
На основании первого закона термодинамики (3.36), (3.37), а также (3.55), (3.56) или (3.57), количество тепла, сообщаемое газу в изотермическом процессе, равно работе газа в этом процессе:
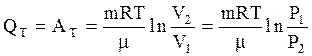 (3.58)
(3.58)
или
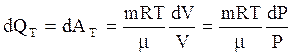 . (3.59)
. (3.59)
Молярная теплоемкость идеального газа в изотермическом процессе согласно (3.31) и условно  бесконечна, т.е. сколько бы ни сообщалось тепла газу, температура его не изменяется. Приращение энтропии в изотермическом процессе, исходя из (3.34) и (3.59), определится по формуле
бесконечна, т.е. сколько бы ни сообщалось тепла газу, температура его не изменяется. Приращение энтропии в изотермическом процессе, исходя из (3.34) и (3.59), определится по формуле
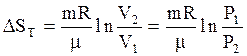 . (3,60)
. (3,60)
г). Рассмотрим адиабатический процесс, при котором некоторая масса m идеального газа теплоизолирована, т.е. количество тепла не сообщается газу и не отнимается у него
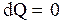 и
и 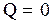 . (3.61)
. (3.61)
Теплоемкость идеального газа в адиабатическом процессе согласно (3.31) и (3.61) равна нулю. Приращение энтропии газа в адиабатическом процессе на основании (3.34) и (3.31) также равно нулю, т.е. энтропия идеального газа в адиабатическом процессе остается постоянной и такой процесс называют изоэнтропическим. Из первого закона термодинамики (3.36) и (3.37), а так же (3.61), следует, сто в адиабатическом процессе работа совершается газом за счет приращения его внутренней энергии:
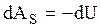 и
и 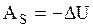 . (3.62)
. (3.62)
Подставляя в (3.62) значение  из (3.16), получим
из (3.16), получим
 (3.63)
(3.63)
из (3.63) следует, что в адиабатическом процессе изменяются и температура, и давление, и объем газа. Получим уравнение адиабаты, связывающее эти параметры, оно называется уравнением Пуассона. Для этого в (3.37) подставляем (3.16), (3.28), (3.61)  , (3.64)
, (3.64)
затем подставим в (3.64) выражение для 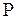 из (3.9) и умножим (3.64) почленно на
из (3.9) и умножим (3.64) почленно на  , тогда получим:
, тогда получим:  . (3.65)
. (3.65)
Учтем (3.44) и (3.52), тогда (3.65) перепишется в виде
 или
или 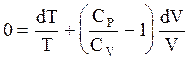 . (3.66)
. (3.66)
Отношение теплоемкостей 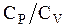 обозначают
обозначают  . Проинтегрировав (3.66), получим:
. Проинтегрировав (3.66), получим:  или
или 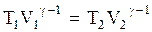 . (3.67)
. (3.67)
Это и есть один вид уравнения адиабаты. Можно получить два других вида уравнений адиабаты:
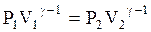 и
и 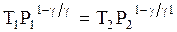 . (3.68)
. (3.68)
Рассмотренные выражения для термодинамических величин в изопроцессах представлены в таблице 3.1.
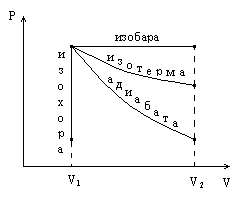
Рис. 3.5
Графически в координатах  и
и  изопроцессы изображены на рис. 3.5, причем начальное состояние системы одно и то же для всех процессов.
изопроцессы изображены на рис. 3.5, причем начальное состояние системы одно и то же для всех процессов.
Таблица 3.1.
| ïðîöåññ âåëè÷èíà | èçîõîðè-÷åñêèé | èçîáàðè-÷åñêèé | èçîòåðìè-÷åñêèé | àäèàáàòè-÷åñêèé |
Ïðèðàùåíèå
 âíóò. ýíåðãèè âíóò. ýíåðãèè
|
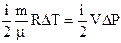
|
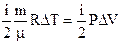
| 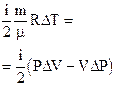
| |
Ðàáîòà, 
|
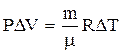
|

| 
| |
| Êîëè÷åñòâî òåïëà, Q |
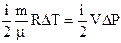
| 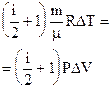
|

| |
Òåïëîåìêîñòü, 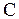
| 
| 
|
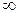
| |
Ïðèðàùåíèå ýíòðîïèè, 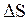
| 
| 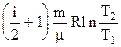
|

|
|
|
Дата добавления: 2014-11-16; Просмотров: 1171; Нарушение авторских прав?; Мы поможем в написании вашей работы!