
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика. Алкены (этиленовые углеводороды, олефины) – это непредельные углеводороды, молекулы которых содержат двойную связь
|
|
|
|
АЛКЕНЫ
Алкены (этиленовые углеводороды, олефины) – это непредельные углеводороды, молекулы которых содержат двойную связь. Общая формула алкенов СПН 2 П.
Простейшие представители:
| Формула | Название | |
| углеводорода | изомера | изомера |
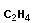
| 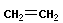
| этен (этилен) |
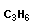
| 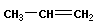
| пропен |

|  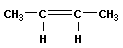 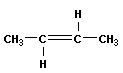 
| бутен-1 цис-бутен-2 транс-бутен-2 2-метил-пропен (изобутен) |
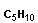
|  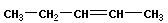  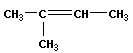
| пентен-1 пентен-2 3-метил-бутен-1 (изопентен-1) 3-метил-бутен-2 (изопентен-2) |
Основным структурным признаком алкенов является наличие связи С=С, в образовании которой участвуют два атома углерода в sp -гибридизованном состоянии. Эта связь осуществляется двумя парами электронов и является сочетанием ковалентных σ –связей и π-связей. σ -связь возникает при осевом перекрывании 2sp -гибридных орбиталей, а π -связь -при боковом перекрывании 2 р -орбиталей соседних sp -атомов углерода.
По своей природе л-связь резко отличается от σ -связи: π -связь менее прочная вследствие меньшей эффективности перекрывания р -орбиталей и сосредоточения р -электронов вне межъядерной оси. Это определяет также бóльшую подвижность л-электронов, т.е. высокую поляризуемость π - связи.
σ -Связи, образуемые тремя 2sp -гибридными орбиталями углерода, находятся в одной плоскости под углом 120 °. Поэтому молекула простейшего алкена - этилена - имеет плоское строение:

Номенклатура. Названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса - ан на - ен: этан —> эт ен; пропан —> проп ен; бутан —> бут ен и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (при этом она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса - ен. Например:
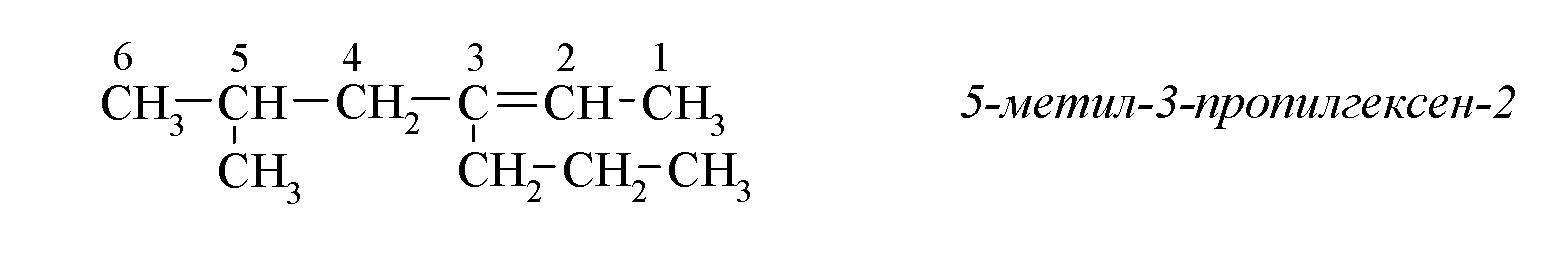
|
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изо-бутилен (2-метилпропен).
В номенклатуре органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
-СН=СН2 - винил, -СН2-СН=СН2 - аллил.
Изомерия. В ряду алкенов проявляется более разнообразная изомерия по сравнению с алканами.
Структурная изомерия
- изомерия положения кратной связи, начиная с С4Н8:
СН2=СН-СН2-СН3 {бутен-1) и СН3-СН=СН-СН3 {бутен-2);
- изомерия углеродного скелета (с С4Н8), например:
СН2=СН-СН2-СН3 {бутен-1) и СН2=С(СН3)г {метилпропен);
- межклассовая изомерия с циклоалканами, начиная с С3Н6:

|
Пространственная изомерия алкенов связана с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение (л-диастереомерия) [10].
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух л - диастереомеров (цис- и транс-, или Z- и Е-), отличающихся расположением заместителей относительно плоскости л-связи. Например, в молекуле бутена-2 СНз-СН=СН-СНз группы СНз могут находиться либо по одну сторону от плоскости л-связи в цис изомере, либо по разные стороны в транс-изом&р&. Пространственное строение л-диастереомеров отражают их проекционные формулы:

|
π-Диастереомеры отличаются не только физическими, но и химическими свойствами, поскольку сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию.
Физические свойства алкенов сходны с алканами. Низшие гомологи С2Н4-С4Н8 - газы, алкены С5Н10-С17Н34 - жидкости, далее - твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях (бензол, тетрахлорметан, эфиры и т.п.).
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 6520; Нарушение авторских прав?; Мы поможем в написании вашей работы!