
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Удельная теплота сгорания топлива
|
|
|
|
Цетановое число
Цетановое число — характеристика воспламеняемости дизельных топлив, определяющая период задержки воспламенения смеси (промежуток времени от впрыска топлива в цилиндр до начала его горения). Чем выше цетановое число, тем меньше задержка и тем более спокойно и плавно горит топливная смесь. Цетановое число численно равно объёмной доле цетана (С16Н34, гексадекана), цетановое число которого принимается за 100, в смеси с α-метилнафталином (цетановое число которого, в свою очередь, равно 0). Чем оно больше, тем лучше воспламеняемость смеси при сжатии.
Стандартное топливо характеризуется цетановым числом 40—45, а топливо высшего качества (премиальное) имеет цетановое число 45—50. Согласно российским стандартам, цетановое число летнего и зимнего дизтоплива должно быть не менее 45 единиц.
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обычное топливо (уголь, нефть, бензин) содержит углерод. При горении атомы углерода соединяются с атомами кислорода, содержащегося в воздухе, в результате чего образуются молекулы углекислого газа. Кинетическая энергия этих молекул оказывается больше, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения и называют выделением энергии.
Энергия, выделяющаяся при полном сгорании топлива, называется теплотой сгорания этого топлива.
Теплота сгорания топлива (или количество теплоты, выделяющееся при его сгорании) зависит от вида топлива и его массы. Чем больше масса топлива, тем большее количество теплоты выделится при его полном сгорании.
Физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании 1 кг топлива, называется удельной теплотой сгорания этого топлива.
Удельную теплоту сгорания топлива обозначают буквой q и измеряют в джоулях на килограмм (Дж/кг) или в джоулях на м3 (Дж/ м3).
q - удельная теплота сгорания топлива.
Удельную теплоту сгорания разных видов топлива можно найти в таблице 1.
Таблица 1- Удельная теплота сгорания некоторых видов топлива, Дж/кг
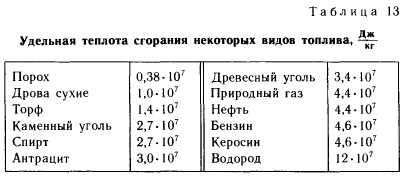
Из этой таблицы, например, видно, что удельная теплота сгорания торфа равна 1,4•107Дж/кг. Это число показывает, что при полном сгорании торфа массой 1 кг выделится количество теплоты, равное 1,4•107 Дж. При сгорании 2 кг торфа выделится в 2 раза больше энергии, при сгорании 3 кг - в 3 раза больше и т. д.
Количество теплоты, выделяющееся при сгорании произвольной массы топлива, находят по формуле:
Q = qm
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
Контрольные вопросы
1. Напишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре.
2. Приведите структурную формулу углеводорода С5Н12, образующего при бромировании только одно монобром-производное.
3. На полное сгорание 0,1 моль алкана неизвестного строения израсходовано 11,2 л кислорода (при н. у.). Какова структурная формула алкана?
4. Какова структурная формула газообразного предельного углеводорода, если 11 г этого газа занимают объем 5,6 л (при н. у.)?
Контрольные задания
Напишите уравнения реакций с одним молем брома для следующих углеводородов:
| 1) | 1-пропана, 2-метил-2-бутена | 2) | бутана, 2,3-диметил-1-бутена |
| 3) | изобутана, 1-пентена | 4) | 2,2-диметилбутана, 1-бутена |
| 5) | 2,3-диметилбутана, 1-гексена | 6) | 2,2-диметилпентана, 2,6-диметил-2-октена |
| 7) | 2-метилпентана, 2-метил-2-пентена | 8) | 2,3-диметилпентана, 3,3-диметил-1-пентена |
| 9) | изогексана, 2,4-диметил-2-пентена | 10) | 2,4-диметилгексана, 2,3,3-триметил-1-бутена |
| 11) | 3-этилпентана, 2-метил-1-бутена | 12) | 2,2,3-триметилпентана, 2,3-диметил-1-бутена |
| 13) | гексана, 1-гексена | 14) | октана, 3-октена |
| 15) | 2,3-диметилгексана, 3,4-диметил-2-гексена | 16) | 2-метилпропана, 2-метилпропена |
| 17) | 3-метил-1-бутена, 2-метилбутана | 18) | 3-метилпентана, 1-пентена |
| 19) | 3-метилпентана, 1,3-бутадиена | 20) | 2,3,3-триметилгексана, пропена |
| 21) | пентана, | 22) | 2-метилбутана, |
| 4-метил-2-пентена | 2-метил-1-гексена | ||
| 23) | 3,3-диметилпентана, 2-метил-3-гексена | 24) | 2,4-диметилпентана, 2,4-диметил-1-пентена |
| 25) | гептана, 1,4-пентадиена | 26) | гептана, 2-метил-1-пентена |
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 5509; Нарушение авторских прав?; Мы поможем в написании вашей работы!