
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие. Реакция является обратимой, если в системе наряду с образованием продуктов происходит превращение продуктов в исходные вещества
|
|
|
|
Реакция является обратимой, если в системе наряду с образованием продуктов происходит превращение продуктов в исходные вещества.
a A(г)+ b B(г))  Û e E(г)+ f F(г)
Û e E(г)+ f F(г)
Δ rG < 0 (реакция прямая) Δ rG >0 (реакция обратная)
∆ rG = ∆ rHТ - T ∆ rSТ
энтальпийный энтропийный фактор
При некоторых условиях энтальпийный (∆rHТ) и энтропийный фактор (T∆rSТ) могут уравновешиваться и тогда свободная энергия системы (ΔrG) минимальна, а возможность протекания прямой и обратной реакций – равновероятна.
Термодинамическое условие химического равновесия:
∆rG = 0 (p, Т = const) и ∆rF = 0 (v, Т = const)
Кинетическое условие химического равновесияυ прям. = υ обр
Химическое равновесие – особое состояние системы, при котором состав смеси с течением времени не меняется при неизменных условиях. В этом состоянии: система – равновесная, состав смеси – равновесный, концентрации и парциальные давления – равновесные.
Для равновесной гомогенной системы - закон действующих масс:
Кс = 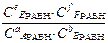 Кp =
Кp = 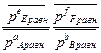
Кс и Кр - константы равновесия (зависят от природы и Т) Кр = Кс (R*T)∆n
Изменение числа молей газов в результате реакции ∆n =(e+f) – (a + b)
R* = 0,082 атм.л.моль-1.К-1
В выражение Кр и Кс гетерогенных систем не входят компоненты в более конденсированном состоянии.
Парциальное давление - pi = 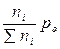
Кр =[ neE равн nfF равн / (naA равн nbB равн)](Р0 /Σni равн)∆n
где Σni равн = nE равн + nF равн + nA равн + nB равн
Чем больше убыль ∆rG, тем сильнее сдвинуто равновесие вправо, тем выше Кp.
| ∆rG0Т= - RT ln Кр | для реакций в газовых системах |
| ∆rG0Т= - RT ln Кс | для реакций в конденсированных системах |
Задача 13
Определите Т, при которой в реакции СаСО3(к)=СаО(к) +СО2(г) рСО2,равн = 104 Па.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 374; Нарушение авторских прав?; Мы поможем в написании вашей работы!