
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. Пренебрегаем зависимостью ∆rH0 и ∆rS0 от Т:
|
|
|
|
Кр = рСО2, Кр = 104/105=0,1.
Пренебрегаем зависимостью ∆rH0 и ∆rS0 от Т:
∆rG0Т = ∆rH0298 –T∆rS0298 = -RTlnКр
∆rH0298=∆fH0298,СаО+∆fH0298,СО2-∆fH0298,СаСО3= 178,1 кДж;
∆rS0298 = S0298,CаО+ S0298,СО2 - S0298,СаСО3 = 160,5 Дж/К
178,1.103 –Т.160,5= -8,31Тln0,1 Þ Т=991К
Чем больше К, тем выше выход продукта - η – отношение количества (или массы) продукта к максимально возможному его количеству (или массе) при условии полного превращения какого-либо исходного вещества в продукт ( 100 % превращение невозможно с термодинамической т. зрения т.к. Кр становится ∞)
Кр и Кс не зависят от:
· парциальных давлений
· концентраций компонентов
· общего давления в системе
· но зависят от температуры и природы компонентов системы.
ln Kp = - ∆ rG0Т / RT ln Kp = 
Зависимость константы равновесия от температуры - уравнение изобары Вант-Гоффа в дифференциальной форме:  ( ∆ rH0 ¹ f(T) (9)
( ∆ rH0 ¹ f(T) (9)
d ln Kp / dT – температурный коэффициент
ln  =
=  (10)
(10)
Задача 14
Для реакции: А(г) = 2В(г) (Р,Т – const) Кр = 0,02 при 400 К и Кр = 4,00 при 600 К. Определить ∆rH0298, ∆rS0298 и Кр при 800 К.
Решение.
Пусть ∆rH0 и ∆rS0 не зависят от температуры. Составим систему:
 ∆rG0Т1 = ∆rH0298 –T1∆rS0298 = -RT1lnКр1
∆rG0Т1 = ∆rH0298 –T1∆rS0298 = -RT1lnКр1
∆rG0Т2 = ∆rH0298 –T2∆rS0298 = -RT2lnКр2
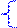 x – 400y = -8,31.400 ln2.10-2
x – 400y = -8,31.400 ln2.10-2
x – 600y = -8,31.600 ln4
х = ∆rH0298 = 52833(Дж) = 52,833 кДж; y = ∆rS0298 = 99,575Дж/К.
ln 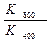 = ln
= ln 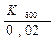 =
=  (
(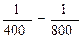 ) = 7,95; К800 = 56,55
) = 7,95; К800 = 56,55
Задача 15
Рассчитать Кр и Кс реакции С(к) + СО2(г) = 2СО(г) при 298 К и 1000 К. ∆ rG0298 =120кДж; ∆ rG01000 =-3,16 кДж. Сделайте вывод о выходе продукта реакции и определите знак энтальпии реакции.
Решение
Кр=  ; Кс=
; Кс=  ∆rG0Т =- RTlnКр
∆rG0Т =- RTlnКр
Kp =exp(-∆G0Т /RT) Кс = 
Кр298 = exp(-120.103/8,31.298) = ехр(-48,5) = 8×10-22;
Kp1000 = exp(+3160/8,31.1000) = ехр(0,38) = 1, 46.
∆n = 2-1=1
Кс 298 = 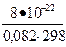 = 3×10-23 Кс 1000 =
= 3×10-23 Кс 1000 = 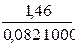 = 0,018
= 0,018
При 298 К Кр << 1 Þ в равновесной смеси практически отсутствуют продукты и равновесие смещено в сторону исходных веществ.
При 1000 К Кр > 1 Þ в равновесной смеси начинают преобладать продукты ( их выход растет с увеличением Т). Кр растет с увеличением Т, т.е.∆rH0 > 0, т. к. из уравнения изобары Вант-Гоффа в дифференциальной форме:  при
при 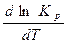 ˃ 0 ∆rH0 >0.
˃ 0 ∆rH0 >0.
Задача 16
Для реакции С(к) + СО2(г) = 2СО(г) Кр 298 =8×10-22; Kp 1000 =1, 46; ΔrН0298 = 172,5 кДж. Объясните увеличение КР с ростом температуры.
Решение:
Зависимость константы равновесия от температуры - уравнение изобары Вант-Гоффа в дифференциальной форме: 
∆rH0 = ΔrН0298 - стандартная энтальпия реакции, которую в 1-ом приближении считают независимой от Т: ∆rH0 ¹ f(T);
dlnKp/dT ˃0 (температурный коэффициент) т. к. ΔrН0298 =172,5 кДж>0 (RT2 >0) сл. с ростом Т Kp увеличивается.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!