
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неблагоприятная ориентация благоприятная ориентация
|
|
|
|
Реакция принципиально возможна при достижении исходными частицами Е>Ea и их надлежащей ориентации (Т=const).
Из уравнения Аррениуса 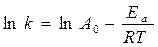 или
или 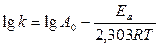
Задача 28
Определите константу скорости реакции 2НI(г) ® Н2(г) + I2(г) при температуре 2000 С, если предэкспоненциальный множитель A0 = 9,2·1013, а энергия активации ЕА = 186,4 кДж/моль. Каков физический смысл константы скорости реакции? От каких параметров и как зависит константа скорости реакции? Укажите ее размерность для Вашей реакции (порядок реакции n =2)
Решение.
Уравнение С.Аррениуса 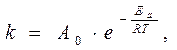
k – константа скорости реакции при данной Т, размерность
А0 – предэкспоненциальный множитель, не зависит от Т
А0 = k, если Еа = 0
Физич. смысл А0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость А0 = z Poр. Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
Уравнение, связывающее скорость реакции с концентрацией исходных веществ, называют кинетическим. Для n=2 основное кинетическое уравнение 
k - константа скорости:
а) не зависит от концентрации
б) зависит от температуры, природы реагирующих веществ, катализатора, площади поверхности раздела фаз.
Физический смысл константы скорости: k – удельная скорость, 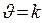 , если С= 1моль/л
, если С= 1моль/л
n = 2 общий порядок реакции
В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости.
Размерность k зависит от порядка реакции. Для n =2 [k ]= л/(моль×с).
При Т=273 +200=473 К k = 9,2·1013. exp(-186400/8,31. 473) = 9,2·1013 e-46= 9,2·10-7 л/(моль×с).
· Аналитический способ определения Еа (из преобразования уравнений Аррениуса для двух Т):
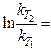 (Еа./R)(1/T1–1/T2) или lgγ = (Еа./2,3R)(10/T1T2)
(Еа./R)(1/T1–1/T2) или lgγ = (Еа./2,3R)(10/T1T2)
и при ∆Т=10 lgγ = (Еа./2,3R)(1/T1–1/T2)
· Графический способ определения Еа: строят график зависимости в координатах (lg k, 1/T).
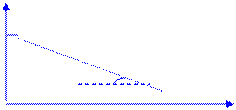 lg k
lg k
lg k0 tg a= 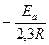
a 1/T
Задача 29
Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400К.
Решение.
Уравнение Аррениуса
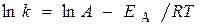
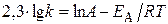
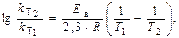 Логарифм отношения констант скоростей реакции при температурах Т2 и Т1
Логарифм отношения констант скоростей реакции при температурах Т2 и Т1
где R = 8,31 Дж/(моль×К) – универсальняая газовая постоянная.
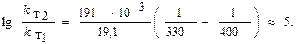
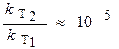 Следовательно,
Следовательно,
- константа скорости увеличится в 105 раз.
Влияние катализаторов на скорость реакции
Катализ - ускорение реакции за счет введения дополнительного вещества – катализатора (Kt), состояние и масса которого в конце реакции остаются неизменными.
k= Аoe-Ea/RT - c катализатором k растет т.к. Еа снижается. Kt входит в состав нового активированного комплекса, отвечающего меньшей Еа,к после распада которого регенерируются в неизменном виде: А+ В + Kt →[ А…В…Kt]→АВ + Kt
Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
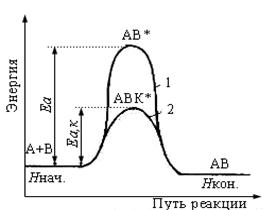
Вывод: Катализатор снижает Е а реакции, что приводит к увеличению доли активных молекул и возрастанию скорости реакции.
Гомогенный катализ: Kt и все реагенты в одном фазовом состоянии (жидком или газообразном).
Ферментативный катализ - природные реакции, катализируемые ферментами - биологическими катализаторами. В организме человека более 30 тысяч ферментов.
Гетерогенный катализ: Kt и реагенты в разных фазах (твердая газообразная; твердая-жидкая) и реакция идет на поверхности Kt - на поверхности раздела фаз, служащем реакционным пространством. Влияние площади реакционной поверхности на скорость реакции - особенность кинетики этих реакций.
Общая скорость гетерогенной реакции первого порядка описывается уравнением (твердое вещество в кинетическое уравнение не входит):
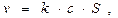
|
где с – концентрация реагента (газообразного или жидкого)
S - площадь поверхности.
Размерность скорости гетерогенной реакции в этом случае [моль×с-1], константы скорости реакции [м×с-1].
Например, кинетика гетерогенной реакции СаО(к) + СО2 = СаСО3(к)
описывается уравнением: 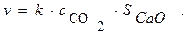
У дельная скорость реакции, отнесенная к единице площади реакционной поверхност и, для n=1описывается уравнением:  )
)
Единица измерения удельной скорости реакции [моль×с-1×м-2].
Гетерогенные катализаторы: металлы, оксиды и соли металлов. Каталитические гетерогенные реакции включают стадии:
ü подвод реагента,
ü адсорбцию на Kt,
ü образование активированного комплекса,
ü образование продукта и его десорбцию.
Зависимость скорости гетерогенной химической реакцииот скорости подвода реагента и отвода продукта с поверхности раздела фаз (зоны химической реакции) является второй особенностью этих реакций.
Стадии гетерогенного катализа:
А + В +Кt→(А –В –Кt)адс →(А…В …Кt) →(АВ)адс + Кt →АВ + Кt
Пример: CO + ½ O2 → СО2 (Pt –Кt)
идет через: образование активированного комплекса
(СО…О…Pt) → (СО2)адс + Pt → СО2 + Pt Еа ↓ и υ↑
Kt отличаются:
· активностьюРеакция идет только на активных центрах, обеспечивающих оптимальные условия реакции);
· избирательностью (влияние Kt на скорость определенной реакции);
· универсальностью (влияние Kt – металлов Pd-группы на скорость очень многих реакции);
Вещества, увеличивающие активность Кt – промоторы. Вещества, снижающие активность Кt – каталитические яды (мышьяк, ртуть, свинец для Pt).
В обратимых каталитических реакциях Кt в равной степени ускоряют и прямую и обратную реакцию, сокращая время достижения равновесия.
Автокатализ – kt - один из продуктов реакции
Для автокаталитических реакций: А→В (В –Kt) Кинетическое уравнение 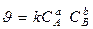 Пример: FeO + H2 = Fe + H2O Fe - kt
Скорость обратимых реакций зависит от скоростей прямой и обратной реакции: А + В Û= Д + К Пример: FeO + H2 = Fe + H2O Fe - kt
Скорость обратимых реакций зависит от скоростей прямой и обратной реакции: А + В Û= Д + К
При равновесии СDСK/ САС В =Kc =kпр/kобр Вывод общая скорость гетерогенной химической реакции зависит, и удельная скорость не зависит от площади реакционной поверхности. На скорость гетерогенной химической реакции влияют процессы массопереноса. Скорость обратимой реакции определяется разностью скоростей прямой и обратных реакций. |
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 464; Нарушение авторских прав?; Мы поможем в написании вашей работы!
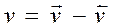 = kпр СА С В – kобр СD СK
= kпр СА С В – kобр СD СK
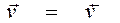 или kпр САС В = kобрСDСK
или kпр САС В = kобрСDСK