
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая кинетика
Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих состояние равновесия, то равновесие смещается в сторону уменьшения эффекта внешнего воздействия.
Смещение химического равновесия
- это процесс изменения равновесного состава системы вследствие изменения внешних условий и установление нового равновесного состава.
Направление смещения равновесия подчиняется принципу Ле Шателье:
Вывести систему из состояния равновесия можно изменяя:
· а) температуру,
· б) общее давление
· в) парциальные давления газообразных реагентов или концентрации (активности) реагентов в растворах.
В соответствии с данным принципом:
ü При увеличении Т равновесие смещается в сторону эндотермической реакции, а при уменьшении Т – в сторону экзотермической реакции.
ü При увеличении общего давления (Po) равновесие смещается в сторону образования меньшего числа молей газообразных реагентов ( νi).
ü При увеличении парциального давления (или концентраций) исходных веществ равновесие смещается в сторону прямой реакции, при уменьшении концентрации (ci) исходных веществ или при увеличении концентрации (ci) продуктов реакции равновесие смещается в сторону исходных реагентов.
Задача 17
Как увеличить выход продуктов реакции С(к) + СО2(г) = 2СО(г)
ΔrН0298 = 172,5 кДж >0
Решение
В соответствии с принципом Ле-Шателье вывести систему из состояния равновесия можно изменяя температуру, общее давление, парциальные давления газообразных реагентов или концентрации (активности) реагентов в растворах.
Чтобы повысить выход продукта СО нужно равновесие смещать вправо:
а) Увеличить Т системы, т.к. ∆rH0298 > 0 (При увеличении Т равновесие смещается в сторону эндотермической реакции). При этом константа равновесия Кр возрастает.
б) Уменьшить Рсистемы, т.к прямая реакция идет с увеличением числа молей газообразных веществ (При снижении общего давления равновесие смещается в сторону образования большего числа молей газообразных реагентов). Кр не зависит от общего давления, Кр не изменяетттся.
в) Увеличить парциальное Р СО2 и уменьшить парциальное Р СО(выводить СО из сферы реакции)- при увеличении парциального давления (или концентраций) исходных веществ или при уменьшении концентрации (ci) продуктов реакции равновесие смещается в сторону прямой реакции. Кр не зависит от концентрации (парциального давления), Кр не изменяетттся.
Равновесный состав системы, если известен начальный состав, можно рассчитать, применяя закон действующих масс и составляя уравнения материального баланса.
Задача 18
Определить равновесный состав системы С(к) + СО2(г) = 2СО(г). Реакция протекает при: Т = 1000 К и постоянном давлении Ро = 2атм. В начале реакции система состояла из n(СО2)исх = 5 моль СО2; mугля = 1 кг; продукт отсутствовал. Kp 1000 = 1,46
Решение
Кр =[ n2СО равн / (n СО 2 равн)](Р0 /Σni равн)∆n,
где ∆n = 2-1=1 и Σni равн = n СО 2 равн + n СО равн
Таблица материального баланса
| Компонент | С | СО2 | СО |
| Нач. состав nисх моль | - | ||
| Изменение ∆n, моль | - | х | 2 x |
| Равновесный n равн, моль | - | 5 – x | 2 x |
Kp 1000= 1,46
Кр = 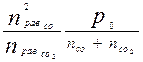 Кр =
Кр = 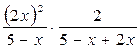 = 1,46 х = 1,7 моль.
= 1,46 х = 1,7 моль.
При равновесии: n(СО2)равн = 5-1,7=3,3 моль CO2; n(СО)равн= 2×1,7=3,4 моль CO.
Масса прореагировавшего угля ∆mугля = ∆ n M угля = х M угля = 1,7. 12 = 20,4 г
Задача 19
Определить ССО2 равн и ССО равн для реакции С(к) + СО2(г) = 2СО(г)
Реакция протекает при Т = 1000 К в закрытом сосуде v = 2 л. В начальный момент: mисхCO2 =44 г; продукт отсутствовал; уголь в избытке. К с1000 =0,018
На сколько изменится давление в системе при равновесии по сравнению с исходным?
Решение.
Сисх СО2 = 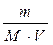 =
= 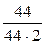 = 0,5 моль/л;
= 0,5 моль/л;
Таблица материального баланса
| Компонент | С | СО2 | СО |
| Начальные концентрации Сисх, моль/л | - | 0,5 | |
| Изменение концентраций ∆С, моль/л | - | х | 2 x |
| Равновесные концентрации С равн, моль/л | - | 0,5 – x | 2 x |
Кс =0,018
Кс = 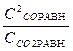 ; Р = сR*T; Кс =
; Р = сR*T; Кс = 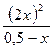 = 0,018. х = 0,0387 моль/л
= 0,018. х = 0,0387 моль/л
С СО равн = 2. 0,0387 = 0,0774 моль/л, С CO2 равн = 0,5 - 0,0387 = 0,4613 моль/л
Р 0 = сисх R*T = 0,5 . 0,082.1000 = 41 атм
Р равн= ∑ с равн R*T = (0,0774 +0,4613).0,082.1000 = 44,173атм D Р = 3,173атм
изучает скорость, механизм протекания процесса и факторы, влияющие на скорость.
Скорость реакции - количество вещества, образующееся в единице реакционного объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции) в единицу времени
Гомогенная реакция протекает в гомогенной системе, гетерогенная – на границе раздела фаз.
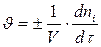 моль/(л.с)
моль/(л.с) 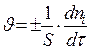 моль/ (м2с)
моль/ (м2с) 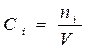 , моль/л
, моль/л
V -объём реакционной зоны; S -поверхность раздела фаз;
τ- время; n i – количество i – го вещества.
Средняя скорость 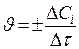 (в определенный промежуток времени) Мгновенная скорость
(в определенный промежуток времени) Мгновенная скорость 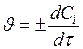 (в конкретный момент времени).
(в конкретный момент времени).
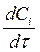 для исходных веществ < 0, для продуктов > 0.
для исходных веществ < 0, для продуктов > 0.
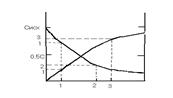
Кинетические кривые – кривые, отражающая изменение концентрации какого-либо вещества от времени в ходе реакции
А → В С = f (τ)
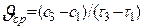
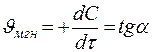
Задача 20
За 1 с в единице реакционного пространства образуется по трем реакциям 66 г СО2, 68 г Н2S и 51 г NН3. Скорость образования какого из веществ больше?
Решение. Количество вещества (ν) в молях каждого из продуктов реакции
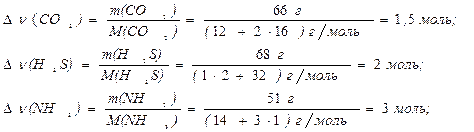 |
Скорость образования NН3 больше, чем скорости образования Н2S и СО2, т.к. ∆υ(NH3) > ∆υ(H2S) >∆υ(CO2).
Простые (элементарные) реакции протекают в одну стадию.
Сложные – суммарный результат протекания нескольких простых реакций.
Простые классифицируют по молекулярности. Молекулярность - число молекул, участвующих в элементарном химическом акте: целое (+) число: 1,2, реже 3:
1 – мономолекулярные: I2 ® 2I
2 – бимолекулярные: H2 + I2 ® 2HI
3 – тримолекулярные: 2NO + Cl2 ® 2NOCl
Запись простой реакции отражает механизм ее протекания, с ложной – не отражает механизма протекания процесса: 2N2O5 ® O2 + 2N2 O4
Стадии:
1 N2O5 ® O2 + N2O3 быстро
2 N2O3 ® NO + NO2 медленно
3 2NO2 ® 2N2O4 быстро
медленная стадия (2) – лимитирующая стадия, определяет скорость
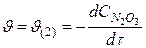
Cкорость реакции зависит от:
1) природы реагирующих веществ,
2) концентрации или давления реагирующих веществ,
3) температуры
4) катализатора
Влияние концентрации на скорость реакции
Условия протекания реакции A+B→ K +L:
1 - одновременное нахождение А и В в определённой точке реакционного пространства;
2 - удачное их столкновение.
Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации: ω A = α×Cа A, ω B = β×C в B.
Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения: ω = ω A × ω B = α×Cа A × β×Cв B.
γ – доля удачных столкновений 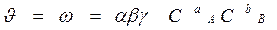
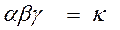 константа скорости реакции
константа скорости реакции
Уравнение, связывающее скорость реакции с концентрацией исходных веществ - кинетическое.
Основное кинетическое уравнение 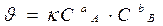
k - константа скорости:
а) не зависит от концентрации
б) зависит от температуры, природы реагирующих веществ, катализатора, площади поверхности раздела фаз.
k – удельная скорость: 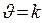 , если СА = С В = 1моль/л
, если СА = С В = 1моль/л
а, в – частные порядки реакции по веществам А и В (определяются экспериментально), n = (а + в) – общий порядок реакции
В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости. H2 + I2 ® 2HI – простая (элементарная) реакция
а (Н2) = 1, в (I2)=1,т.е. порядки реакции по веществам равны стехиометрическим коэффициентам n = 1+1 =2 Þ
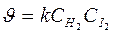 закон действующих масс для химической кинетики.
закон действующих масс для химической кинетики.
В сложных реакциях: n = 0, целочисленные, дробные, (-),(+) (определяются экспериментально)
Уравнения, связывающие концентрацию исходных веществ и время
(Т = const)
Реакции 1-го порядка А ® В CH3OCH3® CH4 + H2 + CO
Кинетическое уравнение реакции первого порядка: а) 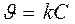 .
.
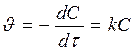 , l nC – lnC0 = -kt Þ lnC = lnC0 - kt
, l nC – lnC0 = -kt Þ lnC = lnC0 - kt
С0 – исходная концентрация
С - концентрация в момент времени t
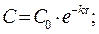
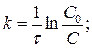
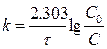 [ k ] =[с-1]
[ k ] =[с-1]
Для реакций 1-го порядка зависимость lgC от t линейная:
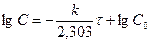
 lg C
lg C
lg C o
tga = - 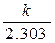
t, с
период полупревращения τ1/2: время, за которое прореагировала половина исходного количества вещества. τ1/2 служит критерием скорости реакции (чем меньше τ1/2, тем выше скорость реакции)
C = 0,5C0 Þ 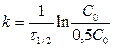
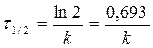 -не зависит от С о для n=1
-не зависит от С о для n=1
б) Степень превращения χ = [(С0 – С)/C0]100 %, 0 ≤ χ ≤ 1
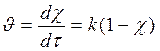 , С = С0(1- χ),
, С = С0(1- χ), 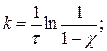
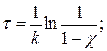
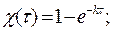 .
.
Реакции 2-го порядка A + B → продукты или 2А ® продукты
Кинетическое уравнение: а) 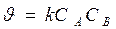 , если C0 A = C0 B
, если C0 A = C0 B 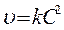 ,
,
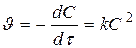 ,
, 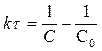 ,
, 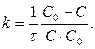 [k] = [л×моль-1×с-1],
[k] = [л×моль-1×с-1], 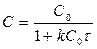
 Для реакции 2-го порядка зависимость 1/С от t линейная
Для реакции 2-го порядка зависимость 1/С от t линейная 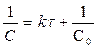
|
|
Дата добавления: 2014-11-18; Просмотров: 1213; Нарушение авторских прав?; Мы поможем в написании вашей работы!