
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на скорость реакций
|
|
|
|
C
1/C0 a tga = k
τ, с
Период полупревращения для реакций 2-го порядка C = ½ C0 
 t ½ - обратно пропорционально начальной С0 для n=2.
t ½ - обратно пропорционально начальной С0 для n=2.
б)  , если C0 A = C0 B
, если C0 A = C0 B  ,
,
С = С0(1- χ), 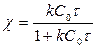
в) Если С0А - СА= С0В - СА = х и C0 A ≠ C0 B, то 
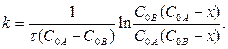 ;
;  ; СА = С0А – х; СВ = С0В - х
; СА = С0А – х; СВ = С0В - х
г) для реакции рA + qB → продукты 

кинетические уравнения в дифференциальной форме:
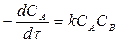 ,
,  ;
;
текущие концентрации связаны со степенью превращения χ:
СА = С0А(1- χА), СВ = С0В(1- χВ), кинетические уравнения  ,
, 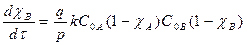
Реакции 0-го порядка: А ® продукты
 ,
, 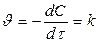 , С = С0 - kt; [ k]= [моль л-1 с-1]
, С = С0 - kt; [ k]= [моль л-1 с-1]
Для реакций 0-го порядка зависимость C от t линейная:
 C
C
C o
tga = - k t, с
Период полупревращения для реакций 0-го порядкаt1/2 = С0 /2k, k = С0 /2t1/2,
t ½ - прямо пропорционально начальной С0 для n=0.
Реакции 3-го порядка: А + В + C ® продукты
 , если C0 A = C0 B = C0C, то
, если C0 A = C0 B = C0C, то  ,
,  ,
,  , [k] = [л2×моль-2×с-1];
, [k] = [л2×моль-2×с-1];
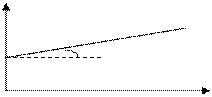 Для реакции 3-го порядка зависимость 1/С2 от t линейная
Для реакции 3-го порядка зависимость 1/С2 от t линейная 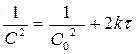 ;
;
1/C2
a tga = k
1/C02
t, с
Период полупревращения для реакций 3-го порядка  для n=3.
для n=3.
и  t ½ - обратно пропорционально квадрату начальной С0
t ½ - обратно пропорционально квадрату начальной С0
Степень превращения χ = [(С0 – С)/C0]100 %. Достичь 100% - го превращения (С = 0 моль/л) для реакций первого, второго и третьего порядков невозможно, так как ln0 (n=1) – не существует, 1/0 = ∞ (или τ100% = ∞ для n=2) и 1/02 = ∞ (или τ100% = ∞ для n=2). Для n=0 τ100% = С0/k.
Задача 21
При температуре 100°С константа скорости реакции второго порядка
2НI(г) ® Н2(г) + I2(г) равна 8,83×10-16 л/(моль×с). Определите время полупревращения йодистого водорода, если начальная концентрация его равна 1 моль/л. Совпадают ли молекулярность и порядок реакции? Напишите основное кинетическое уравнение для реакции.
Решение.
Простые (элементарные) реакции протекают в одну стадию. Сложные – суммарный результат протекания нескольких простых реакций.
Простые реакции классифицируют по молекулярности. Молекулярность - число молекул, участвующих в элементарном химическом акте, целое число: моно-, би-, реже тримолекулярые реакции.
Порядки реакции по веществам определяются экспериментально. В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости, т.е. порядки реакции по веществам равны стехиометрическим коэффициентам.
Из размерности [k] = л/(моль×с) порядок реакции n = 2. Т.к. порядок реакции совпадает со стехиометрическим коэффициентом перед исходным веществом в реакции НI, то реакция 2НI(г) ® Н2(г) + I2(г) элементарная или простая, и.молекулярность и порядок реакции совпадают: реакция бимолекулярная, порядок n = 2, основное кинетическое уравнение: 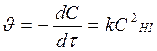 . (
. (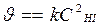 закон действующих масс для химической кинетики).
закон действующих масс для химической кинетики).
Период полупревращения τ1/2: время, за которое прореагировала половина исходного количества вещества С=0,5 С0
Для реакции второго порядка

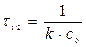
период полупревращения обратно пропорционален начальной концентрации (чем больше С0, тем τ1/2 меньше).
Задача 22
Для реакции первого порядка А ® 2В определите время, за которое прореагирует 90 % вещества А. Константа скорости реакции k1 = 10-4 с-1.
Решение.
После превращения 90 % вещества А его концентрация составит 10% от начальной концентрации, т. е. С = 0,1 с0.
Кинетическое уравнение реакции первого порядка:  .
.
Решение кинетического уравнения lnC = lnC0 - kt
где С0 – исходная концентрация; С - концентрация в момент времени t
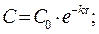
Время, за которое прореагирует 90% вещества 
τ =(1/ 10-4)ln(10) = 23026 с = 6,4 ч.
Задача 23
В реакции А ® В + С с общим порядком, равным единице, константа скорости k1 = 5×10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла 0,2 моль/л.
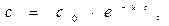 |
Решение.
Для реакции 1-го порядка справедливо уравнение
где с – текущая концентрация вещества в момент времени τ, с0 – начальная концентрация, k – константа скорости, τ – время.

Через 1 час
 Через 5 часов
Через 5 часов
Таблица материального баланса
| Компонент | А | В | С |
| Начальные концентрации С0, моль/л | 0,2 | 0 | 0 |
| Изменение концентраций ∆С, моль/л | х = С0 -С А | х = С0 -С А | х = С0 -С А |
| В момент времени τ С τ, моль/л | 0,2-х | x | x |
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль А получается 1 моль В.
 Поэтому через 1 час
Поэтому через 1 час
 Через 5 часов
Через 5 часов 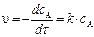
Рассчитаем скорость реакции по уравнению:
 Через 1 час
Через 1 час
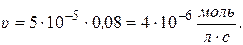
Через 5 часов
 lgC
lgC
 lgCo tga = -
lgCo tga = - 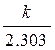
t, с
Задача 24
Во сколько раз изменится скорость газофазной реакции 2СО(г)+О2(г)®2СО2(г) при увеличении давления в системе в 10 раз? Температура системы поддерживается постоянной.
Решение.
Предположим, что рассматриваемая реакция является элементарной, т. е. для нее справедлив закон действующих масс: υ = k×с2(СО)×с(О2).
Концентрация и парциальное давление при постоянной температуре связаны прямо пропорциональной зависимостью рi = сi×R*T, а рi = (ni/∑ni)×Pобщее. (ni и ∑ni – число молей газообразного компонента и суммарное число молей газов в смеси). С увеличением общего давления пропорционально увеличивается парциальное давление каждого компонента газовой смеси Тогда можно записать, что υ= k×р2(СО)×р(О2). После увеличения давления в системе в 10 раз парциальное давление каждого из реагентов возрастет тоже в 10 раз и скорость реакции: υʹ= k×100р2(СО)×10р(О2) = 1000 k×р2(СО)×р(О2).
Отсюда υ¢/υ = 1000. Следовательно, скорость реакции увеличится в 1000 раз.
Задача 25
При изучении кинетики термического разложения ацетона, являющейся реакцией первого порядка, в соответствии с уравнением:
СН3СОСН3(г) ® С2Н4(г) + СО(г) + Н2(г) получены следующие экспериментальные данные при Т = 802 К: давление в реакторе изменилось от начального р0 = 312 мм. рт. ст. до р = 408 мм. рт. ст. за 390 с. Рассчитайте константу скорости реакции.
Решение.
Все вещества в системе находятся в газообразном состоянии, и, учитывая условия проведения опыта, предполагаем, что они подчиняются законам идеальных газов. Следовательно, концентрация и парциальное давление газа связаны зависимостью pi=ci×R*×T или сi = pi /(R*T)
Для реакции I-го порядка  и
и
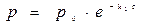 Таблица материального баланса:
Таблица материального баланса:
| Компонент | СН3СОСН3(г) | С2Н4(г) | СО(г) | Н2(г) |
| Начальные парц. давления, мм рт.ст. | p0 | 0 | 0 | 0 |
| Именение парц. давлений, мм рт.ст. | - Dр | Dр | Dр | Dр |
| Парц. давления в момент времени τ, мм рт.ст | p0 – Dp | Dр | Dр | Dр |
р0 = 312 мм рт. ст – начальное давление ацетона в реакционном сосуде.
Из материального баланса к моменту времени τ=390 с:
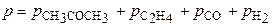 = 408 мм рт.ст.
= 408 мм рт.ст.
По стехиометрии реакции 1 моль ацетона, распадаясь, образует 3 моль газа. Из закона Авогадро следует, что при уменьшении парциального давления ацетона на Dр сумма парциальных давлений образовавшихся газов составит 3Dр. Таким образом, можно записать p = (p0 – Dp) + 3×Dp= p0 +2Dp =312 +2Dp =408, Dp = 48 мм рт.ст.
Парциальное давление ацетона через 390 с после начала опыта составило (p0 – Dp) = 312 – 48 = 264 мм. рт. ст.
Для n=1 k1 = (1/τ) ln[p0/(p0 – Dp)] = (1/390)ln[312/264] = 4,28.10-4 c-1
Задача 26
В реакции второго порядка А + В ® D за 1 час концентрации веществ А и В уменьшились по сравнению с начальной с0А = с0В = 0,2 моль/л на 30 %. Определите константу скорости и скорость реакции в начальный момент времени и через час после начала реакции.
Решение.
Концентрации веществ А и В за 1 час уменьшились на 0,3×с0 = 0,06моль/л. Отсюда, через час концентрации составят сА = сВ = 0,2 – 0,06 = 0,14(моль/л).
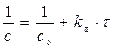 Для реакции II-го порядка
Для реакции II-го порядка
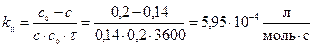
Скорость реакции в начальный момент (τ=0) υ=kC02 = 5,95.10-4(0,2)2 = 2,38.10-5 моль/(л. с), через 1 час (сА = сВ = 0,14(моль/л) υ=kC2 = 5,95.10-4(0,14)2 = 1,17.10-5 моль/(л. с),.
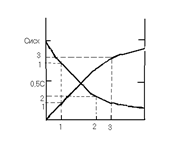
Методы определения порядка реакции
Экспериментально измеряют Среагир.веществ = f (t).
1) Полученные данные (С и t) подставляют в формулы для констант скорости реакций 1, 2 и т.д. порядков. Критерий справедливости кинетического уравнения - постоянство k.
2) По полученным данным строят графики:
а) если реакция 1-го порядка Þ график зависимости в координатах (lg C, t) - прямая линия,
б) если реакция 2-го порядка Þ график в координатах (1/ C, t) - прямая линия.
б) если реакция 3-го порядка Þ график в координатах (1/ C2, t) - прямая линия.
Задача 27
При исследовании кинетики реакции распада диметилового эфира CH3OCH3=CH4 +H2 + CO были получены следующие данные:
| Время, с (t) | 390 | 777 | 1195 | 3150 | ¥ |
| Повышение давления, Па (Dр×10-4) | 1,28 | 2,35 | 3,33 | 6,23 | 8,25 |
Начальное давление диметилового эфира 4,16×104 Па. Рассчитайте порядок реакции и константу скорости распада диметилового эфира.
Решение.
 Предположим, что реакция имеет первый порядок:
Предположим, что реакция имеет первый порядок:
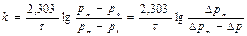 |
Вместо концентраций используем давления, тогда получим
 |
Подставляя соответствующие значения изменения давления со временем в полученное уравнение, рассчитаем константу скорости:
Константа скорости постоянна в пределах погрешности эксперимента, следовательно, предположение, что реакция является реакцией I-го порядка, верно. Отсюда kср = 4,36×10-4 с-1.
Правило Вант-Гоффа: в области невысоких температур (0÷300) 0 С при увеличении температуры на 100 скорость реакции возрастает в 2 – 4 раз.
γ = (2-4) - температурный коэффициент, он показывает, во сколько раз увеличивается скорость при повышении температуры на 100
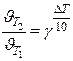 или
или  при С=const (для приблизительных расчётов)
при С=const (для приблизительных расчётов)
 gэкзотерм.< gэндотерм. J DrН>0
gэкзотерм.< gэндотерм. J DrН>0
DrН<0
Т
Аррениус: К реакции приводит столкновение лишь активных молекул, энергия которых больше определённой величины энергии Ea , необходимой для ослабления и перестройки связей, т.е. для перехода веществ в состояние активированного комплекса
Активированный комплекс – переходное состояние системы (старые связи ослабли, новые не сформировались), для его образования необходима энергия Еа
Для реакции: АВ + ДС → АД + ВС

 А – В А….В А - Д
А – В А….В А - Д

 +
+
Д – С Д….С В - С
Исходные молекулы активированный комплекс продукты реакции
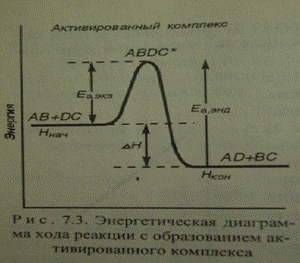
Для обратимой реакции АВ + ДС Û АД + ВС (Еаэкз ˂ Еаэнд):
∆rHпр = Hкон. – Hнач = Еапр - Еаобр Þ связь термодинамических и кинетических параметров
Величина Еа отражает влияние природы исходных частиц на скорость реакции (чем прочнее связи, тем труднее их разорвать, тем больше Еа и меньше скорость). Определяют на основании значений Есвязей.
Еа большинства реакций (40 ÷400) кДж/моль.
Доля активных частиц растет под действием:
тепловой, световой, электрической энергий, рентген. лучей и др.
При увеличении Т число активных частиц ↑ и скорость ↑
Уравнение С.Аррениуса 
k – константа скорости реакции при Т;
А 0 – предэкспоненциальный множитель, не зависит от Т;
А 0 = k , если Е а = 0.
Физич. смысл А 0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость А 0 = z P oр
 Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1623; Нарушение авторских прав?; Мы поможем в написании вашей работы!