
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 3. Получение оксида меди (II) разложением гидроксида меди(II) и его взаимодействие с кислотой (показательный)
|
|
|
|
Белые порошкообразные продукты горения магния на воздухе (опыт 1) перенести в пробирку с дистиллированной водой, добавить 2 капли индикатора фенолфталеина.
Опыт 2. Взаимодействие продуктов горения магния с водой
Взять в тигельные щипцы стружку магния и поджечь.
Опыт 1. Получение бинарных соединений магния реакцией горения (показательный)
Лабораторной работе №5
на тему: «Классификация неорганических веществ»
Цель работы:
Теория:
Охарактеризовать внешний вид металлического магния.
Объяснить, почему в обычных условиях металлический магний устойчив на воздухе.
Отметить, как протекает реакция: активно или нет, что выделяется;
- стружка магния сгорела полностью или нет, объяснить;
- охарактеризовать внешний вид продуктов реакции;
- охарактеризовать состав воздуха;
- составить уравнения реакций магния с основными компонентами воздуха:
Mg + O2 →
Mg + N2 →
- вывод:
- Отметить наблюдения;
- охарактеризовать растворимость оксида и гидроксида магния в воде;
- фенолфталеин окрасился в ……………………..цвет, это свидетельствует о том, что среда в растворе полученных продуктов ……………………..
- составить уравнения реакций взаимодействия бинарных соединений магния с водой:
MgO + H2O →
- составить уравнение электролитической диссоциации гидроксида магния;
Mg(OH)2↓ 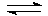
- охарактеризовать кислотно-основные свойства оксида и гидроксида магния.
Получить в пробирке голубой осадок гидроксида меди(II) взаимодействием нескольких капель раствора СuSO4 с раствором щелочи NaOH. Осторожно нагреть полученный осадок. Как изменяется цвет? Составить уравнения реакций.
Опыт 4. Получение оксида углерода (IV) разложением малахита [(CuOH)2CO3] и его взаимодействие с водой (показательный)
На дно пробирки поместить небольшое количество измельченного малахита – карбоната гидроксомеди (II). Пробирку закрыть пробкой с газоотводной трубкой и закрепить в штативе в наклонном положении. Газоотводную трубку погрузить в пробирку с дистиллированной водой с 1 каплей индикатора метилоранжа. Пробирку с малахитом нагреть в пламени спиртовки до полного завершения реакции:
- охарактеризовать внешний вид малахита до реакции …………
- по мере его нагревания происходят изменения…………..
- составить уравнение термического разложения карбоната гидроксомеди (II):
to
(CuOH)2CO3 → ….… + ….… + …
- отметить, как изменяется цвет индикатора – метилоранжа в пробирке с дистиллированной водой
- составить уравнение реакции взаимодействия оксида углерода (IV) с водой:
CO2 + H2O 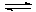 …
…
- составить уравнения диссоциации угольной кислоты:
1 стадия: H2CO3 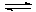 …
…
2 стадия: HCO3- 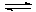 …
…
- составить выражения и привести значения (табл.) констант диссоциации угольной кислоты по первой и второй стадии;
- охарактеризовать кислотно-основные свойства оксида углерода (IV) и угольной кислоты;
- назвать все полученные соединения и ионы, содержащие углерод;
- привести все известные названия оксида углерода (IV).
Вывод
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1245; Нарушение авторских прав?; Мы поможем в написании вашей работы!