
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Опыт 1. Сероводород и его свойства
|
|
|
|
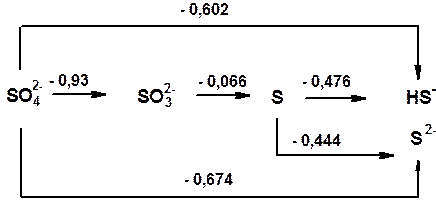
Диаграмма Латимера для серы
а) в кислой среде:

б) в щелочной среде:
- Значения стандартных окислительно-восстановительных (электродных) потенциалов
φ(S/H2S) = +0,144 … …..φ(Se/H2Se) = - 0,115………. φ(Te/H2Te) = -0,464………
- окислительная активность халькогенов в ряду: (S Se Te) …………………:
- восстановительная активность халькогенидов в ряду: (S-2 Se-2 Te-2) ……………:
- Укажите, какие свойства в окислительно-восстановительных реакциях могут проявлять халькогеноводородные кислоты:
Все опыты проводить в вытяжном шкафу, так как все соединения серы ядовиты!
а) Получение сероводорода и его горение
Пробирку, на 1/3 наполненную мелкими кусочками сернистого железа, закрепить в штативе. Добавить в нее концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Быстро закрыть пробирку пробкой с отводной трубкой. Выделяющийся газ зажечь у конца отводной трубки. Над пламенем горящего газа подержать смоченную дистиллированной водой индикаторную бумажку.
- отметить, какие изменения происходят в пробирке
- выделяется газ -……..
- Составить уравнение реакции взаимодействия сульфида железа (II) с соляной кислотой (получения сероводорода)
FeS + HCl → …..…… + ……
- Составить уравнение реакции горения сероводорода
H2S + O2 → …..…… + ……
- Указать окислитель ………………..и восстановитель………….
б) Растворение сероводорода в воде
В пробирку с сульфидом железа (II) добавить концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Закрыть пробирку пробкой с изогнутой трубкой. Выделяющийся сероводород направить в пробирку, наполненную дистиллированной водой. Добавить в полученную сероводородную воду индикатор.
- Отметить и объяснить изменение цвета индикатора, указав, что собой представляет водный раствор сероводорода.
- Написать уравнения диссоциации сероводородной кислоты по 1-ой и по 2-ой ступени
1 ст. H2S → …..…… + ……
2 ст. HS- → …..…… + ……
- Составьте выражения для констант диссоциации по 1-ой и по 2-ой ступени.
K1 = K2 =
- Выписать значения констант диссоциации из таблицы.
K1 = 1,05 10-7 K2 = 1,23 10-13
- Сделать вывод о свойствах сероводородной кислоты.
в) Восстановительные свойства сероводорода
В две пробирки внести растворы: в первую - 5 капель перманганата калия и 2 капли 2н. раствора серной кислоты, во вторую - 5 капель дихромата калия и 2 капли 2н. раствора серной кислоты. В каждую из пробирок добавлять по каплям сероводородную воду до изменения окраски растворов и помутнения вследствие выделения серы.
- отметить, какие изменения происходят в пробирках
- Составить уравнение реакции взаимодействия сероводорода с перманганатом калия, учитывая, что KMnO4 переходит - в сульфат марганца (II) и образуется сера
KMnO4 + H2S + H2SO4 → MnSO4 + …… + ……
- Указать окислитель ………………..и восстановитель………….
- Составить уравнение реакции взаимодействия с дихроматом калия, учитывая, что что K2Cr2O7 переходит в Cr(III) и образуется сера
K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + …… + ……
- Указать окислитель ………………..и восстановитель………….
- Сделать вывод о свойствах сероводорода.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 2117; Нарушение авторских прав?; Мы поможем в написании вашей работы!