
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации растворов
|
|
|
|
ЖИДКИЕ РАСТВОРЫ
В зависимости от природы растворителя:
· Водные растворы - растворитель Н2О
· Неводные растворы - все другие растворители: NH3, CCl4, CH3COOH…
По способности проводить электрический ток:
· Растворы электролитов - проводят
· Растворы неэлектролитов - не проводят.
Концентрация и растворимость -основные характеристики растворов.
Концентрация – содержание компонента раствора в единице объема или массы раствора или растворителя
1. Молярная концентрация, С -количество растворенного вещества в единице объема этого раствора
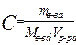 , [моль/л, моль/м3]
, [моль/л, моль/м3]
Задача 1.
Вычислите молярную (с) концентрацию 1,3-пропандиола НОСН2-СН-СН2ОН в растворе, в 1 литре которого содержится m = 8 г вещества.
Решение
Молярная массавещества: МНОС3Н6ОН = 76 г/моль
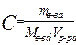 = 8/(76.1) = 0,105 моль/л
= 8/(76.1) = 0,105 моль/л
2. Молярная концентрация эквивалента, Сэк -количество молей эквивалента растворенного вещества в единице объема этого раствора
 , [моль экв/л, моль экв/м3], где fэ - фактор эквивалентности
, [моль экв/л, моль экв/м3], где fэ - фактор эквивалентности
Задача 2:
Вычислите молярную концентрацию эквивалентов Н2SО4, если молярная концентрация Н2SО4 в растворе С = 2 моль/л
Решение
Эквивалент Н2SО4 равен ½ молекулы Н2SО4: Э(Н2SО4) = ½Н2SО4 и фактор эквивалентности fэ = ½.
С эк =  = 4 моль/л.
= 4 моль/л.
3. Титр, Т - масса растворенного вещества (в граммах) в 1 мл раствора
 , [г/мл]
, [г/мл]
Задача 3.
Вычислите титр раствора, в 1 литре которого содержится m = 8 г вещества - 1,3-пропандиола НОСН2-СН-СН2ОН..
Решение
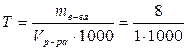 = 0,008 г/мл
= 0,008 г/мл
Задача 4.
Вычислите титр раствора серной кислоты с молярной концентрацией С = 2 моль/л
Решение
Молярная массасерной кислоты: М(Н2SО4) = 98 г/моль

4. Массовая доля вещества, w -отношение массы растворенного вещества к общей массе раствора
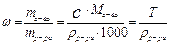 , [доли единицы или %],
, [доли единицы или %],
здесь rр-ра - плотность раствора [г/см3, кг/дм3]
Задача 5.
Рассчитайте массовую долю (ω%) 1,3-пропандиола НОСН2-СН-СН2ОН в водном растворе, в 1 литре которого содержится m =8 г данного вещества. Плотность раствора примите равной 1 г/см3.
Решение
Массовая доля растворенного вещества (%) 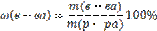
Определим массу раствора, приняв его плотность равной 1 г/см3: mр-ра = V.ρ.1000 = 1.1.1000= 1000 г
Массовая доля 1,3-пропандиола равна:
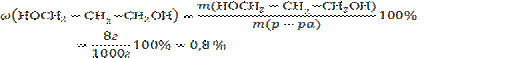
Задача 6.
Рассчитайте массовую долю (ω) серной кислоты в водном растворе с молярной концентрацией С = 2 моль/л. Плотность раствора примите равной 1 г/см3.
Решение
Молярная массасерной кислоты: М(Н2SО4) = 98 г/моль
Массовая доля растворенного вещества: 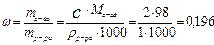 или ω% =0,196.100 = 19,6 %
или ω% =0,196.100 = 19,6 %
Задача 7.
Рассчитайте массовую долю (ω) серной кислоты в водном растворе, титр которого Т = 0,196 г/мл. Плотность раствора примите равной 1 г/см3.
Решение
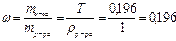 или ω% =0,196.100 = 19,6 %
или ω% =0,196.100 = 19,6 %
Задача 8.
Вычислите титр раствора 1,3-пропандиола НОСН2-СН-СН2ОН с массовой долей 0,008. Плотность раствора примите равной 1 г/см3.
Решение
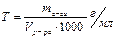 , а
, а 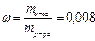
Масса раствора: mр-ра = V.ρ.1000, г (где V, л – объем раствора, ρ, г/см3, кг/дм3 – плотность раствора), тогда
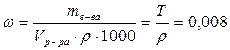 .
.
Принимая ρ= 1 г/см3 рассчитаем титр раствора НОСН2-СН-СН2ОН: Т=ω.ρ=0,008.1= 0,008 г/мл
5. Моляльность, Сm -количество растворенного вещества приходящееся на 1 кг растворителя
 , [моль/кг растворителя]
, [моль/кг растворителя]
Задача 9.
Вычислите моляльную концентрацию вещества в растворе (с m ), в 1 литре которого содержится m = 8 г вещества - 1,3-пропандиола НОСН2-СН-СН2ОН.
Решение
Молярная массавещества: МНОС3Н6ОН = 76 г/моль
Масса 1 л раствора (ρ = 1 г/см3 = 1 кг/дм3): mр-ра = V.ρ.1000 = 1.1.1000= 1000 г
Масса растворителя в 1 л раствора: mН2О = mр-ра –mв-ва = 1000 – 8 =992 г
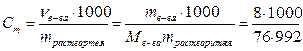 = 0,106 моль/кг Н2О
= 0,106 моль/кг Н2О
6. Молярная доля вещества, x В -отношение числа молей одного из компонентов раствора к сумме молей всех компонентов раствора. 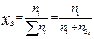 .
.
Молярная доля может быть выражена в долях единицы или в процентах (%).
Задача 10.
Вычислите молярную долю 1,3-пропандиола НОСН2-СН-СН2ОН в растворе (хв), в 1 литре которого содержится m = 8 г НОС3Н6ОН.
Решение
Молярная массавещества: МНОС3Н6ОН = 76 г/моль
Количество растворенного вещества 
Масса 1 л раствора (ρ = 1 г/см3 = 1 кг/дм3): mр-ра = V.ρ.1000 = 1.1.1000= 1000 г
Масса растворителя в 1 л раствора: mН2О = mр-ра –mв-ва = 1000 – 8 =992 г
Молярная массарастворителя: МН2О = 18 г/моль
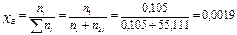 Количество растворителя
Количество растворителя 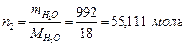
Молярная доля вещества в растворе
Задача 11.
Имеется раствор Аl2(SО4)3 с массовой долей w = 10% и плотностью r = 1,105 г/см3. Каковы молярная концентрация, молярная концентрация эквивалента с эк, титр Т, моляльность с m и молярная доля вещества этого раствора?
Решение.
1. Масса 1л раствора равна: m р-ра = rр-ра . V р-ра = 1,105×1000 = 1105г. По определению массовой доли, в 100г раствора содержится 10г Аl2(SО4)3, следовательно, в 1105г (т. е. в 1л) соответственно (1105×10)/100 = 110,5г. Молярная масса Аl2(SО4)3 (SО4)3 = 342г/моль. Таким образом, в 1л раствора содержится 110,5/342 = 0,32моль Аl2(SО4)3 и молярная концентрация раствора равна 0,32моль/л.
2. Эквивалент молекулы Аl2(SО4)3 равен 1/6 молекулы:
Э(Аl2(SО4)3) = 1/6 Аl2(SО4)3. Соответственно, 1моль-эквивалент составляет 1/6 часть моля Аl2(SО4)3. Следовательно, в одном моле Аl2(SО4)3 содержится 6 моль-эквивалентов, а в 1л данного раствора 0,32×6 = 1,92моль-экв Аl2(SО4)3. Молярная концентрация эквивалента с эк (или нормальная концентрация) равна 1,92моль/л или 1,92н.
3. Поскольку выше было найдено, что в 1000мл раствора содержится 110,5г растворенного вещества, то в 1мл находится 110,5/1000 = 0,1105г Аl2(SО4)3 и титр раствора Т = 0,1105г/мл.
4. По условию, в 100г раствора содержится 10г Аl2(SО4)3 и 90г Н2О. Тогда на 1000г Н2О приходится (1000×10)/90 = 111,11г Аl2(SО4)3. Это составляет 111,11/342 = 0,325моля. Следовательно, в 1000г растворителя Н2О содержится 0,325моля растворенного вещества Аl2(SО4)3 и моляльность раствора с m, по определению, равна 0,325моль/1000г Н2О.
5. Из данных п. 1 следует, что в 1л раствора (1105г) содержится 110,5 г Аl2(SО4)3 и 1105-110,5=994,5г Н2О. Это составляет 994,5/18 = 55,25молей. Откуда молярная доля Аl2(SО4)3 в растворе x Аl2(SО4)3 = 0,32/(0,32 + 55,25) = 0,0058.
Термодинамика процесса растворения
растворение

 Растворение - самопроизвольный, обратимый процесс D Gрастворения < 0 А(к)
Растворение - самопроизвольный, обратимый процесс D Gрастворения < 0 А(к)  А(р-р)
А(р-р)
кристаллизация
Растворение протекает, пока не установится равновесие: D Gраст =0, Jраст=J кр.
Насыщенный раствор - раствор, в котором в данных условиях дальнейшее самопроизвольное растворение невозможно.
Ненасыщенный раствор - самопроизвольное растворение вещества еще возможно: D Gраств < 0, Jраств > Jкр.
Растворимость вещества (С р) в данных условиях = концентрации насыщенного раствора, выражается в моль/л. Абсолютно нерастворимых веществ нет.
Растворимость в жидком растворителе
· Твердых веществ -зависит от природы вещества, растворителя, Т: при ↑Т в процессах с DН > 0 Ср ↑, в процессах с DН < 0 Ср ↓.
· Жидкостей - зависит от природы вещества, растворителя, Т (при ↑Т Ср ↑, т.к. DНрастворения > 0).
В зависимости от природы жидкостей:
А) неограниченная растворимость - жидкости смешиваются в любых соотношениях («подобное растворяется в подобном») и DН = 0 или при образовании прочных связей - DН < 0. Температура, начиная с которой имеет место неограниченная растворимость – критическая температура растворения (КТР) – табличная величина);
Б) ограниченная растворимость – жидкости растворяются друг в друге лишь частично и прочные связи не образуются.
С внесением третьего вещества Ср ↓.
· Газов -зависит от природы вещества, растворителя, Т, Ргаза:
- при ↑Ргаза Ср ↑ (по закону Генри m i = kPi, k –постоянная Генри, г/Па, Pi - давление газа над раствором)
- при ↑Т в процессах с DН < 0 (полярные растворители) Ср ↓, в процессах сDН >0 (органические малополярные растворители) Ср ↑
Чем прочнее связи газ-растворитель, тем лучше растворимость (полярное в полярном, неполярное в неполярном).
С внесением 3 – го вещества ↓ Ср
Современная физико-химическая теория растворов (Ломоносов, Нернст, Оствальд, Аррениус, Вант-Гофф, Менделеев, Каблуков)рассматривает процесс растворения как совокупность нескольких стадий.
Основные стадии процесса растворения:
1) разрушение химических и межмолекулярных связей: D Н1 > 0 (для газов и жидкостей D Н 1- очень мала);
2) сольватация (гидратация) – химическоевзаимодействие растворителя с растворяющимся веществом с образованием комплексов переменного состава – сольватов (гидратов): D Н2 < 0;
3) самопроизвольное перемешивание (диффузия) сольватов по всему объему раствора: D Н3 = D Ндифф > 0
D Н раств = D Н 1 + D Н 2 + D Н 3 > или < 0 [кДж/моль], D Н раств зависит от массы растворителя
D S раств = D S 1 + D S 2 + D S 3 > или < 0 [Дж/(моль K)],
Например:
при растворении NaClк в Н2О (Т=298 К):
D Н0раств. =335 кДж> 0 (доминирует D Н1); D S0раств =142 кДж/К (большое значение)
т.к D G0растворения = D Н0раств. - TD S0раств < 0, то хорошая растворимость
ОБЩИЕ СВОЙСТВА РАСТВОРОВ
- зависят от концентрации (числа частиц) и практически не зависят от природы растворенных веществ, могут проявляться в полной мере в идеальных растворах.
Идеальный раствор - гипотетический раствор, в котором нет химического взаимодействия между компонентами, образование его не сопровождается тепловыми и объемными изменениями ( DНр= 0 и DVр = 0) и каждый компонент ведет себя в растворе независимо от других компонентов. (Реально к идеальным приближаются очень разбавленные растворы неэлектролитов).
Законы идеальных растворов
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 622; Нарушение авторских прав?; Мы поможем в написании вашей работы!