
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды
|
|
|
|
Вода - очень слабый электролит: Н2О + Н2О Û Н3О+ + ОН- (самоионизация) Н2О Û Н+ + ОН- D H 0298дисс=55,9 кДж; D S 0298дисс =-80,48 Дж/К
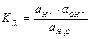 =1,8×10-16 при 25оС
=1,8×10-16 при 25оС
ɑ Н2О = const = 1000/18 ≈ 55,5моль/л Кд • ɑ Н2О = const= КВ (при T= const)
Ионное произведение Н2О: 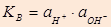 ;
;
 (*) KВ 398 = 6,2×10-13
(*) KВ 398 = 6,2×10-13
К В растет с ростом температуры, т.к. D H 0диссН2О >0
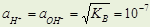 при комнатной Т в нейтральной среде
при комнатной Т в нейтральной среде
Ионы Н+ - носители кислотных свойств, а ОН- - основных свойств.
Прологарифмируем: lgKВ = lgaH+ + lgaOH- = -14
- lgaH+ = рН - водородный показатель; -lgaOH- = рОН - показатель ионов ОН-
логарифмическая форма ионного произведения Н2О: рН + рОН = 14 (298К)
при 298 К
| среда | сН+, моль/л | сОН-,моль/л | рН |
| нейтральная с Н= с он | 10-7 | 10-7 | |
| кислая с Н> с он | >10-7 | <10-7 | <7 |
| щелочная с Н< с он | <10-7 | >10-7 | >7 |
Индикаторы – вещества изменяющие свою окраску при изменении рН (IndOH – либо HInd)
Метилоранж HInd Û H+ + Ind-
красный вкислой среде в щелочной среде желтый
Современный способ измерения рН – рН-метрия
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 422; Нарушение авторских прав?; Мы поможем в написании вашей работы!