
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет рН, если гидролиз идет по катиону и аниону
|
|
|
|
Расчет рН растворов солей с гидролизом по катиону
КГ = КВ/КД основания Þ 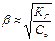 Þ с Н+ = b×со Þ рН= - lg(
Þ с Н+ = b×со Þ рН= - lg(  )
)
(концентрация соли не влияет на b)
КГ = КВ/ (КД кислоты КД основания) Þ  Þ
Þ
с Н+ = 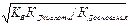 Þ рН = 0,5[- lgK В - lgК Д(к-ты) + lgК Д(осн)] =0,5[рКВ +р К Д(к-ты) - р К Д(осн)]
Þ рН = 0,5[- lgK В - lgК Д(к-ты) + lgК Д(осн)] =0,5[рКВ +р К Д(к-ты) - р К Д(осн)]
(- lgK В = р K В при 250 С р K В = 14)
Задача 22.
Рассчитайте рН 0,1 М раствора K2S, учитывая только 1-ю ступень гидролиза.
Решение.
Соль K2S, являясь сильным электролитом, полностью диссоциирует на ионы: K2S Þ 2 K+ + S2-
0,2 0,1
Следовательно, начальная концентрация сульфид-ионов С0 равна 0,1 моль /л. Гидролизу подвергается анион S2- (учитываем только 1 -ю ступень):
S2- + H2O Û HS- + OH- Из уравнения реакции следует, что в результате гидролиза образуются ОН- - ионы, среда основная, рН > 7.
Поскольку ионный состав растворов гидролизующихся солей очень сложен, расчет рН проводим по приближенной формуле рН = - lg CН+. Для расчета рН нужно сначала определить равновесную концентрацию гидроксид-ионов, а затем - водородный показатель.
Вычислим константу гидролиза 1-й ступени по формуле: КГ = КВ / КД HS-. Для расчета используем КД H S по 2-й ступени (см. пример выше). Из табл. 1 имеем КД 2 H S = 1 . 10-14 и КГ = 10-14 / 10-14 = 1.
Рассчитаем степень гидролиза b из соотношения (9): КГ = 0,1 . b2 / (1 - b) =1; откуда b» 0,9. Таким образом, большая часть сульфид-ионов гидролизована.
(Оценим степень гидролиза по приближенной формуле (10): b = Ö КГ / С0 = Ö 1 /10-1 = 3,16. В результате получаем величину, не имеющую смысла. Следовательно, расчет степени гидролиза по приближенной формуле в данном случае неправомерен).
Определим равновесную концентрацию ОН- - ионов. Поскольку из уравнения гидролиза следует, что СOH- =СHS-, то СOH- = b . С0 = 0,9 . 0,1 = 0,09 моль / л. Рассчитаем рН раствора: рН = 14 — рОН = 14 + lg COH- = 14 — 1,05 = 12,95.
Ответ: рН = 12,95.
Задача 23 .
Вычислите концентрацию раствора FeCl3, рН которого равен 3, учитывая только 1-ю ступень гидролиза.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1641; Нарушение авторских прав?; Мы поможем в написании вашей работы!