
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отклонения от законов идеальных растворов особенно заметны в растворах электролитов
|
|
|
|
Задача 12.
Рассчитайте давление насыщенного пара бензола С6Н6 над раствором нафталина С10Н8 в бензоле (р А ) при 40°С, если в 400г раствора содержится 128г нафталина, а давление насыщенного пара чистого бензола при указанной температуре р ° А = 24144,6Па.
Решение
З акон Рауля D р А = р° А - р А = р° А х В,
где хВ = n/(n+no) – молярная доля растворенного вещества
n и no - количество растворенного вещества и растворителя, моль
р° А, р А - давление насыщенного пара растворителя над чистым растворителем и над раствором, соответственно.
Молярная масса нафталина MC10H8 =128г/моль;
число молей нафталина в растворе n = m C10H8/MC10H8 = 128/128 = 1моль.
Молярная масса бензола MC6H6 = 78г/моль;
число молей бензола в растворе n0 = m C6H6 / MC6H6 = (mр-ра - m C10H8 )/ MC6H6 = (400 – 128)/78 = 3,49 моль.
Молярная доля растворенного вещества (нафталина) в растворе: хВ = n/(n+no)= 1/(1+3,49)=0,22.
Понижение давления насыщенного пара бензола над раствором: D р А = р° А х В = 24144,6.0,22= 5311,8 Па
Давление насыщенного пара растворителя над раствором р А = р° А - D р А = хА =24144,6 - 5311,8 = 18832,8Па
Задача 13.
Рассчитайте давление насыщенного водяного пара над раствором1,3-пропандиола НОС3Н6ОН (р А ) с массовой долей НОС3Н6ОН в растворе ω=0,8 % при Т = 20 ºС, если давление насыщенного водяного пара над водой при той же температуре составляет 2,34 кПа.
Решение
Масса 1 л раствора (ρ = 1 г/см3 = 1 кг/дм3): mр-ра = V.ρ.1000 = 1.1.1000= 1000 г
Массовая доля вещества 
Масса растворенного вещества в 1 л раствора mВ = ω . mр-ра /100 = 0,8.1000/100 = 8 г
Молярная массавещества: МНОС3Н6ОН = 76 г/моль
Количество растворенного вещества 
Масса растворителя в 1 л раствора: mН2О = mр-ра –mв-ва = 1000 – 8 =992 г
Молярная массарастворителя: МН2О = 18 г/моль
Количество растворителя 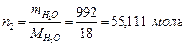
З акон Рауля D р А = р° А - р А = р° А х В,
где хВ = n/(n+no) – молярная доля растворенного вещества
n и no - количество растворенного вещества и растворителя, моль
р° А, р А - давление насыщенного пара растворителя над чистым растворителем и над раствором, соответственно.
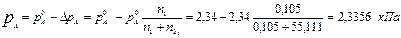 Давление насыщенного водяного пара над раствором:
Давление насыщенного водяного пара над раствором:
Задача 14.
Рассчитайте температуру кипения Ткип и температуру замерзания Тзам водного раствора глицерина С3Н8О3 с массовой долей w = 15%.
Решение
Согласно следствию из закона Рауля растворы малолетучих веществ кипят при температуре выше, чем Т кип чистого растворителя, и кристаллизуются (замерзают) при температуре ниже, чем Т зам чистого растворителя: D Т кип = К э× с m и D Т зам = К к× с m.
К э - эбуллиоскопическая константа, К к - криоскопическая константа - определяются природой растворителя. Для Н2О К э = 0,516 и К к = 1,86.
Рассчитаем моляльность данного раствора.
По условию, в 85г воды содержится 15г глицерина, следовательно, в 1000 г Н2О содержится 15.1000/85 = 177 г глицерина.
Молярная масса глицерина М=92 г/моль.
Моляльность раствора с m = 177/92 = 1,92моль/кг Н2О.
D Т кип = 0,516×1,92 = 0,99, Т кип р-ра = Т кип + D Т кип = 373 + 0,99 =373,99 К.
D Т зам = 1,86×1,92 = 3,57, Т зам р-ра = Т зам - D Т зам = 273 – 3,57 = 269,47 К
Задача 15.
Рассчитайте температуру кипения Ткип и температуру замерзания Тзам водного раствора 1,3-пропандиола НОС3Н6ОН в 1 литре которого содержится m = 8 г 1,3-пропандиола
Решение
Молярная массавещества: МНОС3Н6ОН = 76 г/моль
Масса 1 л раствора (ρ = 1 г/см3 = 1 кг/дм3): mр-ра = V.ρ.1000 = 1.1.1000= 1000 г
Масса растворителя в 1 л раствора: mН2О = mр-ра –mв-ва = 1000 – 8 =992 г
Моляльная концентрация вещества:
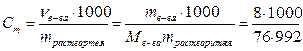 = 0,106 моль/кг Н2О
= 0,106 моль/кг Н2О
По закону Рауля повышение температуры кипения раствора (ΔТкип) и понижение температуры замерзания (ΔТз) по сравнению с температурой кипения и температурой кристаллизации чистого растворителя не зависит от природы растворённого вещества и прямо пропорциональна моляльной концентрации растворённого вещества. Последняя определяется числом молей растворённого вещества в 1000 г растворителя. Закон Рауля выражается
ΔТ == К*Сm
,где Cm - моляльная концентрация
К – криоскопическая или эбулиоскопическая константа;
Т кип(Н2О)= t кип(Н2О)+273=100+273=373K
Т з(Н2О)= t з(Н2О)+273=0+273=273K
Тогда: Т кип= Т кип(Н2О)+ ΔТкип= Т кип(Н2О)+ Кэ* Сm=373+0,516*0,106=373,06 К
Т з= Т з(Н2О)- ΔТз= Т з(Н2О)- Кк* Сm=273-1,86*0,106=272,80 К
Задача 16.
Определите осмотическое давление раствора сахарозы при 0° С, если при 20°С осмотическое давление этого же раствора равно 1,066×105Па.
Решение.
Осмотическое давление - это минимальное давление, которое нужно приложить к раствору, чтобы остановить осмос - одностороннюю диффузию молекул растворителя в раствор большей концентрации через полупроницаемую мембрану.
Согласно закону Вант Гоффа осмотическое давление pосм = СRT,
где С - молярная концентрация, моль/л;
R =8,31Дж/(моль×К) - универсальная газовая постоянная,
Т - температура, К, Т1 = 293 К, Т2 = 273 К
pосм - осмотическое давление, кПа, pосм 1 = 1,066×105Па.
Концентрация раствора сахарозы С = pосм1 /(RT 1) = 106,6/(8,31×293) = 0,047 моль/л.
Осмотическое давление при 0°С pосм2= СRT 2=0,047×8,31×273=114,437 кПа.
Задача 17.
Определите осмотическое давление 0, 105 М водного раствора 1,3-пропандиола НОС3Н6ОН (Росм) при Т = 20 ºС, если.
Решение

R - универсальная газовая постоянная, 8,314 Дж/(моль*К)
Т - температура, К. Т=t+273=273+20=293 К
Молярная концентрация С=0,105 моль/л
Тогда: 
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- растворы, содержащие в заметных концентрациях заряженные частицы, образующиеся в результате электролитической диссоциации растворенного вещества.
Электролитическая диссоциация – процесс образования ионов (Аррениус 1886 г).
Растворение молекулярных веществ:
а) образование сольватированной молекулы:
АВ+(n + m)S Û AB(n + m)S (а)
АВ - растворяемое вещество; S - полярные молекулы растворителя
АВ(n + m)S - сольватированная молекула (сольват).
б) сольват диссоциирует на сольватированные ионы:
АВ(n + m)S Û А q + n S + B q - m S (б)
Процесс сольватации может остановиться на любой стадии.
· только стадия (а) - раствор неэлектролита. Ионов в растворе нет, ионной проводимости нет.
(раствор кислорода и сахара в воде, бензола в толуоле)
· стадии (а) и (б) - раствор электролита. Идет электролитическая диссоциация с образованием ионов.
Уравнения электролитической диссоциации (опуская промежуточные стадии, указав лишь начальные и конечные продукты реакции): АВ + (n + m)S Û А q + n S + В q - m S
(диссоциация муравьиной кислоты в воде HСООН + (n + m)Н2О Û HСОО- n Н2О + Н+ m Н2О;
обычно записывают: НСООН Û НСОО- + Н+
n и m - стехиометрический состав сольватов, не постоянен, зависит от концентрации, температуры и других параметров раствора).
При растворении ионного соединения стадии (а) и (б) -образования сольватов и электролитическая диссоциация совмещены и могут протекать практически необратимо:
А q +В q - + (n + m)S ® А q + n S + B q - m S или А q +В q - ® А q + + B q -
(диссоциация хлористого натрия в воде NaCl ® Na+ + Cl-)
Примеры электролитов: растворы щелочей, солей и ряда неорганических кислот в воде, растворы ряда солей в жидком аммиаке, ацетонитриле и др. органических растворителях.
Наиболее часто растворы электролитов классифицируют по степени диссоциации a: a = с дис / с о - отношение числа молекул, диссоциированных на ионы сдис, к общему числу молекул растворенного электролита с0 (исходной концентрация электролита).
Классификация веществ по степени диссоциации:
a = 0 – неэлектролиты, сдис = 0
a = 1 – сильные электролиты сдис = с 0
a < 1 - слабые электролиты сдис < с 0
a- зависит от:
1. Природы растворенного вещества: a(НF) < a(НСl)
2. Природы растворителя: чем e↑, тем легче рвется связь под действием полярных молекул растворителя и a выше e (Н2О) = 81 e (С6Н6) = 2
3. Температуры: зависимость определяется тепловым эффектом (при D Н0дис˂0 a уменьшается, а при D Н0дис˃0 a увеличивается с ростом Т)
4. Концентрации раствора: с ↑концентрации a уменьшается.
5. При введении одноименного иона ( СН3СООNH4→СН3СОО- + NH4+) равновесие диссоциации уксусной кислоты смещается влево и a уменьшается СН3СООН Û СН3СОО- + Н+ ().

Водные растворы электролитов
Слабые электролиты (a < 1)
слабые электролиты – вода, водные растворы многих неорганических и органических кислот, оснований р -, d - и f -элементов
Для расчета используют основные положения теории Аррениуса: к обратимому процессу диссоциации может быть применен закон действующих масс. Константа равновесия КС называется константой диссоциации.
Чем меньше К Д в данном растворителе, тем слабее диссоциирует электролит.
Для процесса диссоциации слабой кислоты НА Û Н+ + А-
константа диссоциации кислоты К д 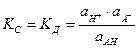
g ≈1 (взаимодействие слабое) Þ а =g × с = с Þ 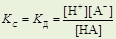
где [H+] – равновесная концентрация Н+
Для процесса диссоциации слабого основания RОН Û R+ + ОН-
константа диссоциации основания К д 
Зависимость a от концентрации слабого электролита
Диссоциация муравьиной кислоты: НСООН Û НСОО- + Н+.
(1 - a)со aсо aсо
со - исходная концентрация кислоты
a - степень диссоциации,
| НСООН | НСОО- | Н+ | |
| Сисх | со | ||
| DС | aсо | aсо | aсо |
| Сравн | со - aсо | aсо | aсо |
 КД = 1,77×10-4 при t = 25° С.
КД = 1,77×10-4 при t = 25° С.
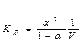 Закон разведения Оствальда:
Закон разведения Оствальда:
или  где V= 1/С0 – разведение).
где V= 1/С0 – разведение).
Степень диссоциации 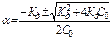
Если a << 1, то К Д» a2 со - приближенная формула закона Оствальда
тогда 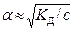 для расчетов с Кд < 10-4
для расчетов с Кд < 10-4
ВЫВОД: a - уменьшается с увеличением концентрации.
Многоосновные слабые кислоты (H2SO3, H2CO3 и т.д.) и многокислотные основания (Zn(OH)2, Al(OH)3 и т.д.) диссоциируют ступенчато:
1-ая ступень Zn(ОН)2 Û ZnОН+ + ОН- К Д1 = 4,4×10-5.
2-ая ступень ZnОН+ Û Zn2+ + ОН- К Д2 = 1,5×10-9.
· Константа диссоциации по каждой последующей ступени всегда на несколько порядков ниже, чем предыдущей: К Д2 << К Д1
· К Д зависит
- от природы диссоциирующего вещества и растворителя (чем меньше КД, тем устойчивее частица),
- от температуры: с Т↑обычно К Д↓ (∆Н < 0)
· К Д не зависит от концентрации раствора.
· величины К Д – табулированы при 250 С.
Сильные электролиты (a = 1)
В водных растворах сильные электролиты -почти все соли, щелочи (гидроксиды s -металлов, кроме Be(OH)2 Mg(OH)2), кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4…
Сильные электролиты диссоциируют полностью, необратимо (нет нераспавшихся частиц):
Ba(OH)2 ® Ba2+ + 2OH-
Al2(SO4)3 ® 2Al3+ + 3SО42-
Þ с ионов большая Þ свойства растворов зависят от взаимодействия ионов друг с другом и с Н2О. g ≠ 1
П.Дебай и Э.Хюккель (1923г.) – понятие ионной атмосферы: каждый ион окружен противоположно заряженными ионами, каждый ион - центр своей ионной атмосферы; в очень концентрированных растворах – ионные пары
При расчете растворов сильных электролитов все основные параметры раствора выражают как функцию суммарного взаимодействия атмосфер с центральными ионами. Энергия этого взаимодействия ↑ при ↑ С и при ↓ Rатм и при ↑плотности заряда атмосферы. В расчетах вместо С используют активность а =g×с
g ± - средний коэффициент активности электролита (определяют экспериментально).
Для электролита А n В m → nАm+ + mВ n-
g ± = среднее геометрическое коэффициентов активности образующих его ионов: 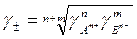
Средний коэффициент активности электролита g ± зависит от природы растворителя и вещества, концентрации, Т
В разбавленных растворах (С<0,1) g i зависит от концентрации и заряда ионов.
Правило ионной силы:
ионы с одинаковой абсолютной величиной заряда в разбавленных растворах сильных электролитов с одинаковой ионной силой имеют равные коэффициенты активности.
Ионная сила раствора I -количественная характеристика межионного взаимодействия: I = 0,5× å (сi ××z2i)
где ci – концентрация i -иона
zi - заряд i -иона
Коэффициенты активности отдельных ионовg i определяют приближенно:
1. По правилу ионной силы, используя справочник для 0,001< I < 0,1
(g I = f(I) - справочная величина)
| Ионы | Коэффициент активности для ионной силы | |||||
| 0,001 | 0,01 | 0,02 | 0,05 | 0,07 | 0,1 | |
| Водорода Однозарядные Двухзарядные Трёхзарядные | 0,98 0,98 0,77 0,73 | 0,92 0,92 0,58 0,47 | 0.90 0,89 0,50 0,37 | 0,88 0,85 0,50 0,37 | 0,86 0,83 0,36 0,25 | 0,84 0,80 0,30 0,21 |
2. По формулам Дебая-Гюккеля для водных растворов:
 (для I» 10)
(для I» 10)  (для I £ 0,01)
(для I £ 0,01)
 Коэффициенты активности отдельных ионов g i:
Коэффициенты активности отдельных ионов g i:
ü в области высококонцентрированных растворов g i =1 и больше.
ü в области очень разбавленных растворов g i → 1
ü в области разбавленных растворов (ниже 0,1 моль/л) g зависят от концентрации и заряда ионов и мало зависят от природы растворенных веществ.
Задача 18.
Определить активность ионов в 0,01 М растворе СаСl2: СаCl2 ® Ca 2+ + 2Cl-
с моль/л: 0,01 2×0,01
Решение: Ионная сила раствора 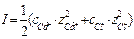 =1/2(0,01×4+0,02×1) = 0,03
=1/2(0,01×4+0,02×1) = 0,03
Коэффициенты активности ионов (по таблице при I =0,03):
 »0,47;
»0,47; 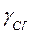 »0,87.
»0,87.
Активность ионов: а  =
=  =0,47×0,01=4,7×10-3 моль/л,
=0,47×0,01=4,7×10-3 моль/л, 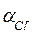 =
= 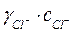 =0,87×0,02=1,74×10-2 моль/л.
=0,87×0,02=1,74×10-2 моль/л.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 815; Нарушение авторских прав?; Мы поможем в написании вашей работы!