
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Присоединение галогеноводородов (гидрогалогенирование)
|
|
|
|
Другой важной реакций электрофильного присоединения к алкенам является давно известное гадрогалогенирование алкенов.
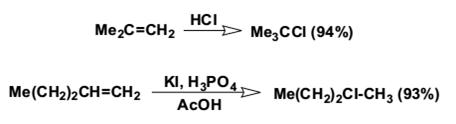
Ниже приведены типичные примеры присоединения HCl, HBr и HI к различным алкенам.
Образование продуктов сопряженного присоединения в реакции галогенирования алкенов также позволяет отвергнуть синхронный механизм присоединения одной молекулы галогеноводорода. Сопряженное присоединение к двойной связи находится в хорошем соответствии с двухстадийным механизмом с участием катиона галогенония в качестве интермедиата.
Влияние алкильных заместителей у двойной связи на скорость присоединения описывается следующей последовательностью: R2C=CHR > RCH=CHR > RCH=CH2
Это согласуется с таким механизмом, в котором в определяющей скорость стадии реакции происходит образование карбокатиона, поскольку стабильность алкильных катионов убывает в ряду третичный > вторичный > первичный. Таким образом, механизм присоединения должен включать промежуточное образование или свободного карбокатиона, что наблюдается редко, или интермедиата с карбокатионным характером. Последний случай наиболее типичен.
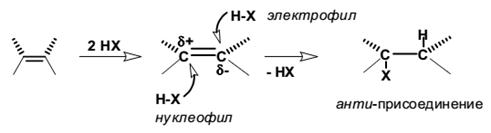
Если бы присоединение происходило через “свободный карбокатион”, то реакция была бы совершенно нестереоселективной, так, как алкильные катионы имеют плоское строение. Однако, гидрогалогенирование, как правило, протекает стереоселективно, причем в зависимости от типа алкена может наблюдаться селективное анти-присоединение, селективное син- или смешанное син-анти-присоединение.
Для алкенов, у которых двойная связь не сопряжена с ароматическим кольцом, характерно анти-присоединение галогеноводорода. Анти-присоединение хлористого и бромистого водорода, хлористого и бромистого дейтерия наблюдается для циклогексена, циклопентена, 1,2-диметилгексена, 1,2-диметилпентена, цис- и транс-бутена-2, гексена-3 и многих других простых алкенов и циклоалкенов.
Анти-присоединение трудно совместимо с механизмом, в котором предполагается образование дискретного карбокатиона. Для плоского карбокатиона нуклеофильная атака галогенид-иона равновероятна с обеих сторон плоскости, что должно привести к образованию смеси продуктов син- и анти-присоединения. Кинетика гидрогалогенирования алкенов также указывает на более сложный механизм присоединения. Для несопряженных алкенов скорость реакции описывается уравнением третьего порядка со вторым порядком по галогеноводороду, т. е. соответствует AdE3-механизму: = k [алкен][HX]2
Анти-присоединение и второй порядок реакции по галогеноводороду хорошо согласуется с AdE3-механизмом, в котором алкен взаимодействует с двумя молекулами галогеноводорода, одна из которых выполняет функцию электрофильного, а другая − нуклеофильного агента.
AdE3-механизм присоединения галогеноводородов к несопряжённым алкенам (региоселективен, стереоспецифичен)
Такой тримолекулярный механизм предполагает, что первоначально образуется комплекс алкена и одной молекулой галогеноводорода с последующей атакой второй молекулы НХ на этот комплекс с анти-стороны без образования дискретного карбокатиона. Следует особо отметить, что любой тримолекулярный механизм должен состоять из двух последовательных стадий, поскольку одновременно столкновение трех молекул крайне маловероятно.
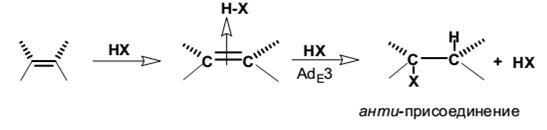
Анти-присоединение свидетельствует о предпочтительной нуклеофильной атаке галогеноводорода со стороны противоположной той, откуда происходит протонирование алкена. Вместо галогеноводорода функцию нуклеофильного агента в конечной стадии может выполнить и галогенид-ион. Действительно, скорость реакции обычно возрастает прямо пропорционально концентрации галогенид-иона, введенного в реакционную смесь в виде галогенидов тетраалкиламмония NR4+X- или лития LiX. В этом случае наблюдается стереоспецифическое анти-присоединение.
Син-присоединение является доминирующим процессом для цис- и транс-изомеров 1-фенилпропена, 1-фенил-4-алкилциклогексенов, аценафтилена, индена. При протонировании таких алкенов образуются карбокатионы бензильного типа, которые стабильнее чисто алкильных катионов, возникающих при протонировании обычных алкенов и циклоалкенов. Кинетика реакции в этом случае обычно описывается более простым уравнением второго порядка v = k[алкен][HX], т. е. соответствует бимолекулярному AdE2-механизму. AdE2-Механизм предполагает образование ионной пары, включающей карбокатион и галогенид-ион.
Асимметрическое присоединение к двойным связям С=С
Асимметрические синтезы, основанные на реакциях присоединения к двойной С=С связи, − это в основном гидроборирование алкенов с помощью хиральных боранов. В результате окисления образующихся при присоединении боранов к алкенам борорганических соединений получаются спирты.

Кроме ди-3-пинанилборана можно использовать также и моно-3-пинанилборан (R*BH2). В настоящее время с помощью этих двух реагентов можно успешно осуществлять синтезы многих оптически активных спиртов.

Из данных таблицы видно, что R*BH2 более эффективен для транс-алкенов и пространственно затрудненных цис-алкенов, тогда как для пространственно незатрудненных цис-алкенов лучше использовать R*BH2. Это необходимо использовать при выборе реагента для конкретного синтеза.
Кроме гидроборирования для асимметрического синтеза на основе алкенов можно использовать реакцию Михаэля − присоединения реагентов с подвижным атомом водорода к активированной двойной связи. Распознающий хиральный центр может или входить в состав одного из реагентов, или быть представлен оптически активным растворителем или катализатором, например:

(B* = хинидин; природный алкалоид).
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1223; Нарушение авторских прав?; Мы поможем в написании вашей работы!