
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Применение первого закона термодинамики к идеальному газу
|
|
|
|
Рассмотрим идеальный газ, т. е. газ, состояние одного моля которого описывается уравнением Менделеева‑Клапейрона:
 (I, 39)
(I, 39)
где 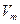 — мольный объём газа, Р и Т — давление и температура соответственно.
— мольный объём газа, Р и Т — давление и температура соответственно.
Состояние идеального газа — это предельное состояние реальных газов при бесконечно малом давлении. Чем выше температура, тем ближе состояние реального газа к идеальному при данном давлении. Однако свойства реального газа всегда отклоняются от свойств идеального газа, так как уравнение (I, 39) является предельным законом для неосуществимого состояния, при котором давление равно нулю. В применении к реальным газам уравнение (I, 39) является приближённым, согласующимся с действительными свойствами газа тем лучше, чем меньше давление и выше температура.
Другим признаком идеального газа является его подчинение установленному опытным путем закону Гей-Люссака‑Джоуля, согласно которому внутренняя энергия идеального газа зависит только от температуры и не зависит от объёма и давления.
Экспериментальное доказательство этого закона было выполнено Джоулем. В калориметр он помещал сосуд, имеющий две камеры А и В, соединённые перекрытой краном трубкой. Он наполнил камеру А газом, а в камере В был создан вакуум. После выравнивания температуры всех частей системы кран открыли. Вследствие этого газ поступал из А в В до тех пор, пока давление в камерах не выровнялось. При этом Джоуль обнаружил лишь очень незначительное изменение температуры. Это означало, что практически не происходил переход тепла от калориметра к камере и наоборот. Предполагается, что если бы этот опыт был выполнен с идеальным газом, то изменения температуры не было бы вовсе.
Применим теперь первый закон термодинамики к описанному выше процессу.
Т. к. Q = 0, то для системы из двух камер и заключенного в них газа имеем:
D U + W = 0, где W — работа, совершаемая системой и D U — изменение внутренней энергии системы. Т. к. суммарный объём камер А и В, составляющих систему, не изменился, 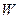 = 0. Поэтому и D U = 0, т. е. энергия системы и, следовательно, газа не изменяется, хотя внутри системы газ сначала занимал только объём А, а в конце процесса заполнял обе камеры А и В. Другими словами, внутренняя энергия идеального газа является функцией только температуры и не зависит от объёма и давления.
= 0. Поэтому и D U = 0, т. е. энергия системы и, следовательно, газа не изменяется, хотя внутри системы газ сначала занимал только объём А, а в конце процесса заполнял обе камеры А и В. Другими словами, внутренняя энергия идеального газа является функцией только температуры и не зависит от объёма и давления.
Из закона Гей-Люссака‑Джоуля следует, что для идеальных газов:
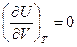 и
и 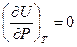
Следовательно, калорический коэффициент  (смотри уравнение (I, 27)) в этом случае численно равен внешнему давлению:
(смотри уравнение (I, 27)) в этом случае численно равен внешнему давлению:
l = P (I, 40)
Подставив значение l в уравнение (I, 38) и принимая во внимание, что из уравнения Менделеева‑Клапейрона для одного моля идеального газа  , окончательно получим:
, окончательно получим:
 , если принять во внимание постоянство R и P. Таким образом, мы получили известное уравнение Майера, устанавливающего соотношение между мольной теплоёмкостью идеального газа при постоянном давлении и мольной теплоёмкостью газа при постоянном объёме:
, если принять во внимание постоянство R и P. Таким образом, мы получили известное уравнение Майера, устанавливающего соотношение между мольной теплоёмкостью идеального газа при постоянном давлении и мольной теплоёмкостью газа при постоянном объёме:
CP – CV =R (I, 41)
Аналогичным образом найдем значение калорического коэффициента h для идеального газа:
 , (I, 42)
, (I, 42)
если принять во внимание постоянство R и Т.
С учётом полученных результатов выражение первого закона термодинамики через калорические коэффициенты для идеального газа будет иметь следующий вид:
δ Q = PdV + CVdT и (I, 43)
d Q = -VdP + CPdT (I, 44)
Из кинетической теории газов следует, что:
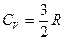 для одноатомных газов (He, Ar, Ne и т. д.)
для одноатомных газов (He, Ar, Ne и т. д.)
 для двухатомных газов (H2, N2, O2, CO и т. д.) и многоатомных газов, имеющих линейное строение (например, СО2, С2Н2 и т. д.)
для двухатомных газов (H2, N2, O2, CO и т. д.) и многоатомных газов, имеющих линейное строение (например, СО2, С2Н2 и т. д.)
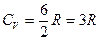 для многоатомных газов нелинейного строения (NH3, CH4, H2S и т. д.)
для многоатомных газов нелинейного строения (NH3, CH4, H2S и т. д.)
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 674; Нарушение авторских прав?; Мы поможем в написании вашей работы!