
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адиабатические процессы в газах
|
|
|
|
Говорят, что термодинамическая система совершает адиабатический процесс, если он обратим и если система термически изолирована, так что во время процесса не происходит теплообмена между системой и окружающей средой.
Если дать возможность газу адиабатически расширяться, то он произведёт работу и её величина будет положительной.
Так как газ термически изолирован (Q = 0), то значение ∆U должно быть отрицательным, т. е. во время адиабатического расширения внутренняя энергия газа уменьшается.
Из уравнения (I, 43) следует:
PdV + CVdT = 0 (I, 45)
Выразив давление из (I, 39) и разделив на T, получим
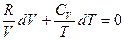
Полагая CV независимым от T и интегрируя, получаем:
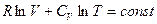
Из (I, 41) следует, что R = CP – CV. Подставляя это выражение для R и деля на CV получаем:
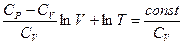
Если ввести обозначение 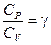 , то после потенцирования получим уравнение адиабаты:
, то после потенцирования получим уравнение адиабаты:
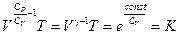 , (I, 46)
, (I, 46)
где K и 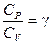 — постоянные. Величина
— постоянные. Величина 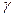 называется показателем адиабаты.
называется показателем адиабаты.
Подстановка 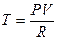 и
и 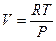 приводит к двум другим возможным формам уравнения адиабаты:
приводит к двум другим возможным формам уравнения адиабаты:
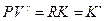 (I, 47)
(I, 47)
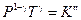 (I, 48)
(I, 48)
Уравнения (I, 46), (I, 47) и (I, 48) являются термодинамическими уравнениями, т. к. они вытекают из первого закона термодинамики и уравнения состояния идеального газа, поэтому применимы лишь к идеальным газам и не являются общими уравнениями, справедливыми для любых систем.
Уравнение (I, 47) следует сравнить с уравнением изотермы для идеального газа:
PV = const
На диаграмме P – V изотермы являются семейством равнобочных гипербол. Адиабата (кривая 1 – 3 (рис.4)) по сравнению с гиперболой (кривая 1 – 2) круче, т. к. показатель степени g больше единицы.
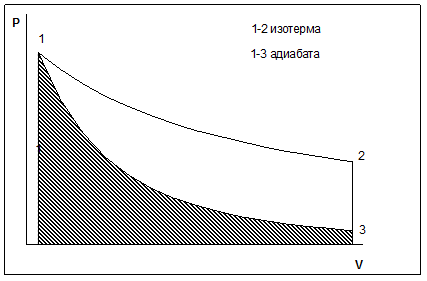
Рис. 4. Работа, совершаемая при адиабатическом расширении идеального газа.
Когда идеальный газ расширяется адиабатически от состояния 1 до состояния 3, кинетическая энергия его молекул, следовательно, и температура газа уменьшаются. Работа, которая производится во время расширения, равна, очевидно, заштрихованной области на рис.4. Она, как уже отмечалось выше, будет положительной
Интересным и простым приложением теории адиабатического расширения газов является вычисление изменения температуры при удалении от земной поверхности. Основной причиной изменения температуры являются конвекционные токи в тропосфере, которые непрерывно перемещают воздух из нижних слоёв в более высокие слои и наоборот. Когда воздух с уровня моря поднимается в верхние слои с низким давлением, он расширяется. Т. к. воздух — плохой проводник тепла, то теплота от окружающего воздуха очень мало передаётся новым подвижным слоям, поэтому можно считать, что происходит адиабатическое расширение. Соответственно понижается температура поднявшегося воздуха. С другой стороны, воздух верхних слоёв атмосферы, опускаясь вниз, испытывает адиабатическое сжатие, вследствие чего повышается температура.
Чтобы рассчитать изменение температуры, рассмотрим столб воздуха с единичным сечением. Гидростатическое давление столба воздуха высотой dH равно rg dH, где g — ускорение свободного падения, а r — плотность воздуха.
Следовательно, при подъёме на расстояние dH давление уменьшится на величину 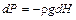 .
.
Из уравнения Менделеева-Клапейрона 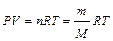 получаем:
получаем:
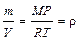 , где m — масса и М — молекулярная масса газа. Тогда
, где m — масса и М — молекулярная масса газа. Тогда
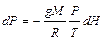 (I, 49)
(I, 49)
После логарифмирования и дифференцирования уравнения (I, 48) получаем:
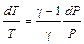 (I, 50)
(I, 50)
Подставляя в (I, 50) значение dP из (I, 49), получаем:
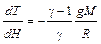
Полагая R = 8,314 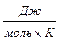 , g = 9,81
, g = 9,81 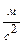 , M = 0,0289
, M = 0,0289  и
и
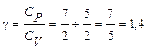 (газы земной атмосферы двухатомны, ничтожными количествами одноатомных инертных газов можно пренебречь), получим:
(газы земной атмосферы двухатомны, ничтожными количествами одноатомных инертных газов можно пренебречь), получим:
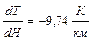
В действительности эта величина несколько больше, чем наблюдаемое среднее снижение температуры в зависимости от высоты над уровнем моря. Разница объясняется главным образом тем, что мы пренебрегли эффектом конденсации водяного пара в расширяющихся массах воздуха.
Рассмотренные ранее отдельные типы процессов (изохорный, изобарный, изотермический и адиабатный) являются частными предельными случаями реальных процессов. Соответствующие им теплоемкости также являются частными видами теплоемкости. Реальные процессы в газах часто протекают по путям, промежуточным между указанными. Эти процессы носят общее название политропных процессов или политроп и могут приближенно характеризоваться значением показателя политропы n в уравнении политропы. Для идеального газа оно имеет следующий вид:
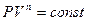
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1342; Нарушение авторских прав?; Мы поможем в написании вашей работы!