
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
|
|
|
|
Расчёт тепловых эффектов по энергиям связей.Понятие химической связипозволяет лучше ощутить природу химической реакции: разрыв и образование связей между атомами играет существенную роль в химической реакции. Теплоты, выделяемые или поглощаемые в химических реакциях, можно вычислить путём сложения теплот, поглощаемых при разрыве связей, и теплот, выделяющихся при образовании новых связей. Теплота, или энтальпия, необходимая для разрыва связи, называется энергией связи.
Например, реакцию  можно записать, обозначив связи в явном виде:
можно записать, обозначив связи в явном виде:

Такая запись показывает, что реакция сопровождается разрывом двух связей водород-водород и одной связи кислород-кислород и образованием четырёх связей кислород-водород. Если энергию связи обозначить eН-Н и ввести аналогичные обозначения для других связей, то тепловой эффект реакции можно представить в следующем виде:
Δ Н = 2e Н-Н + e О-О – 4e О-Н
Для большинства реакций, пользуясь сравнительно небольшими таблицами энергии связей, можно оценить теплоты многих химических реакций.
Значения энергии связей получают как средние величины, вычисленные из опытных термохимических данных. Также следует учесть, что теплоты реакций в этом случае находят для веществ в газообразном состоянии, поэтому при вычислениях учитываются теплоты испарения и сублимации веществ, находящихся в конденсированном состоянии. Таким образом, в общем случае уравнение для расчёта теплоты реакции может быть записано в следующем виде:
Δ Н = (Sn i e i + Δ Нсубл.) исх. – (S  e i) прод.
e i) прод.
По закону Гесса можно вычислить тепловой эффект реакции при той температуре, при которой известны теплоты образования или теплоты сгорания всех реагентов (обычно это 298 К). Однако, часто возникает необходимость в том, чтобы знать тепловые эффекты реакций при различных температурах. Для вывода такой температурной зависимости воспользуемся уравнением

Если qT,P — тепловой эффект химической реакции, протекающей до конца (Dl = 1), при T = const и P = const, то тогда qT,P просто равен Δ Н реакции (смотри (I, 68)):
Δ Н = Н 2 – Н 1 = 
Здесь и в дальнейшем индекс «2» отнесён к продуктам реакции, а индекс «1» — к исходным веществам.
Запишем уравнение химической реакции в общем виде:
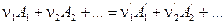
Через Hi обозначим энтальпию i -ого реагента, отнесённую к 1 моль вещества. Так как в результате одного пробега реакции исчезает  моль исходных веществ и появляется
моль исходных веществ и появляется  моль продуктов реакции, то общее изменение энтальпии в процессе будет:
моль продуктов реакции, то общее изменение энтальпии в процессе будет:

Продифференцируем это уравнение по температуре при P = const:
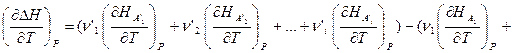

Если теперь ввести обозначения:
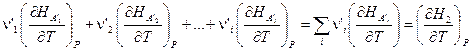
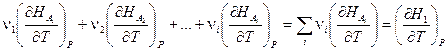
и принять во внимание, что  есть истинная теплоёмкость CP (смотри (I,63)), то тогда
есть истинная теплоёмкость CP (смотри (I,63)), то тогда

где  и
и 
Или окончательно 
Как для идеальной системы, так и для реальных систем при невысоких давлениях частную производную от теплового эффекта по температуре можно заменить полной производной:
 (I, 73)
(I, 73)
Это уравнение впервые было выведено Кирхгофом и называется его именем.
Из уравнения (I,73) получаем:

Интегрирование полученного соотношения от 0 К до Т дает следующее выражение:
 или
или
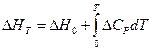 (I, 74)
(I, 74)
где D HT — тепловой эффект реакции при заданной температуре, а D H 0 — константа интегрирования, которую иногда ошибочно называют тепловым эффектом реакции при абсолютно нуле. D H 0 имела бы этот смысл, если бы при интегрировании (I, 73) использовалась функция, сохраняющая своё значение до температур, близких к абсолютному нулю. В большинстве же практических случаев при интегрировании используются зависимости теплоёмкостей, действительные для относительно высоких температур и совершенно непригодные в области абсолютного нуля.
В первом приближении можно считать, что  , тогда интегрирование
, тогда интегрирование
(I, 73) дает следующее выражение:

Если при интегрировании использовать температурную зависимость теплоемкостей в виде степенных рядов (смотри уравнение (I, 17)), то получим следующие более точные соотношения:

 (I, 75),
(I, 75),
где


От трудностей, связанных с необходимостью вычисления константы интегрирования D H 0, легко избавиться, если уравнение Кирхгофа проинтегрировать в интервале температур 298 ÷ Т:

 .
.
Тепловой эффект реакции при 298 К D H 298 может быть рассчитан с использованием четвертого или пятого следствий из закона Гесса.
Расчет тепловых эффектов по уравнению Кирхгофа с использованием температурных рядов для теплоёмкостей является относительно трудоемким. Вычисления значительно упрощаются, если использовать значения средних теплоёмкостей реагентов.
Если принять во внимание уравнение (I, 21), то можно записать:
 , тогда
, тогда
 (I, 76)
(I, 76)
Разности D CP и  могут иметь как положительный, так и отрицательный знак. При этом изменение D HT с температурой определяется видом зависимости D CP (T) или
могут иметь как положительный, так и отрицательный знак. При этом изменение D HT с температурой определяется видом зависимости D CP (T) или  .
.
ГЛАВА II.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1918; Нарушение авторских прав?; Мы поможем в написании вашей работы!