
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы расчета изменения энтропии
|
|
|
|
Второй закон: Энтропия Вселенной всегда возрастает.
Несмотря на некоторые недостатки приведенных выше формулировок, они легко запоминаются и дают представление, о чем собственно идёт речь.
Используя приведённые выше формулировки первого и второго законов (смотри (I, 9) и (II, 17)), можно записать обобщённый закон термодинамики в следующей форме:
dU £ TdS – d W (II, 19)
Знак равенства в этом уравнении относится к равновесным процессам, а знак «меньше» к неравновесным процессам.
Уравнения (II, 12) и (II, 13), определяющие энтропию, являются единственными исходными уравнениями для термодинамического расчета изменения энтропии системы. Заменяя элементарную теплоту в уравнении (II, 13) её выражениями через калорические коэффициенты (см. уравнения (I, 29) и (I, 35)), получаем для равновесных процессов:
 (II, 20)
(II, 20)
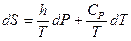 (II, 21)
(II, 21)
Уравнения (II, 20) и (II, 21) являются полными дифференциалами энтропии как функции переменных V, Т или P, Т. Коэффициенты этих уравнений — частные производные энтропии по соответствующим переменным.
Подставив в уравнение (II, 20) значения калорических коэффициентов для одного моля идеального газа: l = P = RT/V (уравнение (I, 40)) и h = – V = – RT/P (уравнение (I, 42)) и полагая СV и СP независимыми от температуры (что допустимо лишь в небольших температурных интервалах), получим после интегрирования в известных пределах:
 (II, 22)
(II, 22)
 (II, 23)
(II, 23)
Применим полученные выше соотношения для расчетов изменения энтропии при некоторых процессах:
1. Фазовые превращения (изотермические процессы; Т = const):
 (II, 24)
(II, 24)
Так, например, теплота плавления бензола равна 9,764 кДж/моль; температура плавления t пл. = 5,5°С (Т = 278,5 К). Следовательно, изменение энтропии 1 моль бензола при плавлении (энтропия плавления) равно:

2. Нагревание при постоянном давлении (изобарный процесс; P = const). Из уравнений (I, 16) и(II, 13) получаем:
 (II, 25)
(II, 25)
Найдем изменение энтропии одного моля алюминия при нагревании от 25 до 600°С. Истинная мольная теплоемкость алюминия может быть выражена уравнением:
Ср= 5,655 + 0,029 Т. По уравнению (II, 6) изменение энтропии будет равно:
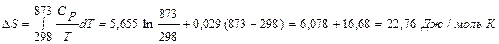
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 997; Нарушение авторских прав?; Мы поможем в написании вашей работы!