
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики
|
|
|
|
Наиболее часто встречающимися и безусловно самопроизвольными являются процессы передачи теплоты от горячего тела к холодному (теплопроводность) и перехода работы в теплоту (трение). Многовековая житейская, техническая и научная практика человечества показали повседневную реальность этих процессов, а также невозможность самопроизвольного протекания обратных процессов, очень заманчивых с практической точки зрения (получение работы за счет отнятия теплоты у тел, окружающих рабочее тело). Это дает основание утверждать, что единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому (постулат Клаузиуса).
Обратный указанному переход теплоты от более нагретого тела к менее нагретому — это обычный неравновесный процесс передачи теплоты путем теплопроводности. Он не может быть обращен, т. е. проведен в обратном направлении через ту же последовательность состояний. Но этого мало: если в системе прошел процесс прямой передачи теплоты, то никаким образом нельзя осуществить такую последовательность любых процессов, в результате которой все тела, участвовавшие в передаче теплоты, пришли бы в исходное состояние и не произошло бы никаких изменений в других телах. Процесс теплопроводности необратим.
Другое общее положение, имеющее ту же опытную основу, утверждает следующее: единственным результатом любой совокупности процессов не может быть превращение теплоты в работу (т. е. поглощение системой теплоты из окружающей среды и отдача эквивалентной этой теплоте работы). Таким образом, самопроизвольный процесс превращения работы в теплоту (путем трения) необратим (так же, как и теплопроводность).
Последнее утверждение может быть изложено иначе: теплота наиболее холодного из участвующих в процессе тел не может служить источником работы (постулат Томсона).
Оба положения (постулаты Клаузиуса и Томсона) являются формулировками второго закона термодинамики и эквивалентны друг другу, т. е. каждое из них может быть доказано на основании другого.
Так как переход теплоты или её превращение в работу рассматривается как единственный результат процесса, то очевидно необходимо, чтобы система, участвующая в теплообмене, возвращалась в результате процесса или совокупности процессов в первоначальное состояние. При таком циклическом процессе внутренняя энергия системы не изменится.
Предположим, что вторая из приведенных выше формулировок (особенно в последней ее форме) неправильна. Тогда можно было бы построить машину, работающую циклами, «рабочее тело» которой периодически возвращалось бы в исходное состояние, причем эта машина давала бы работу за счёт теплоты, поглощаемой извне от тела, не более нагретого, чем сама система и все другие окружающие систему тела. Такой процесс протекал бы без нарушения первого закона термодинамики (работа за счет теплоты), но для практики он равноценен получению работы из ничего, так как всякая машина имела бы практически неисчерпаемый источник теплоты в окружающей среде. Так пароход мог бы двигаться, отнимая теплоту океанской воды и не нуждаясь в топливе. Такая машина называется перпетуум мобиле (вечный двигатель) второго рода. Исходя из этого определения, можно сформулировать второй закон термодинамики, придав постулату Томсона иную форму: перпетуум мобиле второго рода невозможен.
Следует подчеркнуть, что как положения Клаузиуса и Томсона, так и утверждение о невозможности перпетуум мобиле второго рода не доказываются на основании других законов или положений. Они являются предположениями, которые оправдываются всеми следствиями, из них вытекающими, но не могут быть доказаны для всех возможных случаев.
Теорема 1: Для того, чтобы криволинейный интеграл 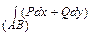 не зависел от пути интегрирования, необходимо и достаточно, чтобы дифференциальное выражение (Pdx + Qdy) было в рассматриваемой области полным дифференциалом от некоторой однозначной функции двух переменных.
не зависел от пути интегрирования, необходимо и достаточно, чтобы дифференциальное выражение (Pdx + Qdy) было в рассматриваемой области полным дифференциалом от некоторой однозначной функции двух переменных.
Теперь естественно, возникает вопрос, по какому признаку можно установить, является ли предложенное дифференциальное выражение полным дифференциалом или нет.
Для того, чтобы получить этот признак в простой и удобной форме, мы дополнительно предположим, что в рассматриваемой области существуют и непрерывны обе частные производные:  и
и 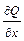 .
.
При этом предположении искомый признак получается сразу. Если дифференциальное выражение есть дифференциал некоторой функции F(x,y), так что имеют место равенства:
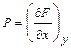 и
и 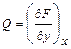 , то
, то 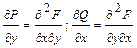
Предполагаемая непрерывность частных производных  и
и 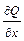 обеспечивает равенство двух смешанных производных, следовательно,
обеспечивает равенство двух смешанных производных, следовательно, 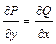
Таким образом, это замечательное по простоте соотношение (соотношение Эйлера) оказывается необходимым и достаточным условием для того, чтобы дифференциальное выражение
(Pdx + Qdy) было полным дифференциалом.
Установим, какое количество теплоты δ Q нужно затратить, чтобы перевести газ из состояния (P,V,T) в бесконечно близкое состояние (P+dP, V+dV, T+dT).
δ Q = PdV + СvdT
Исключим из этого уравнения dT. Для этого продифференцируем уравнение Менделеева-Клапейрона:
PdV + VdP = RdT
и определим из него dT:
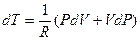
После подстановки получим:
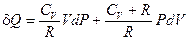
Принимая во внимание, что СV + R = CP, окончательно получим:
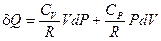 и
и
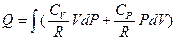
Полученное уравнение позволяет утверждать, что теплота Q не является функцией состояния и зависит от пути процесса, который к этому состоянию привел, т. к. условие интегрируемости здесь явно нарушено:

т. к. CP ¹ CV
Однако если выражение для элементарной теплоты умножить на 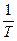 , где
, где 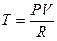 — абсолютная температура, то придем к выражению:
— абсолютная температура, то придем к выражению:
 ,
,
которое явно представляет собой полный дифференциал. Первообразной здесь служит функция, которую мы обозначим S:


Криволинейный интеграл  уже не зависит от пути интегрирования и отличается от указанной выше функции S лишь постоянной.
уже не зависит от пути интегрирования и отличается от указанной выше функции S лишь постоянной.
Полученный нами результат даёт косвенное доказательство существования некой новой функции состояния, названной энтропией, а также её количественной меры.
Дальнейшие исследования позволили дать ещё одну формулировку второго закона термодинамики, являющуюся, безусловно, достаточно точной и краткой. В ней содержится постулат о существовании уже названной нами новой функции состояния, через которую выражается различие между обратимыми и необратимыми процессами:
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!