
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомные и ионные радиусы
|
|
|
|
Периодические свойства элементов
Периодичность выражена в структуре электронной оболочки атомов, поэтому с периодическим законом хорошо согласуются свойства, зависящие от состояния электронов: атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность и валентность элементов. Но от электронной структуры атомов зависят состав и свойства простых веществ и соединений, поэтому периодичность наблюдается во многих свойствах простых веществ и соединений: температура и теплота плавления и кипения, длина и энергия химической связи, электродные потенциалы, стандартные энтальпии образования и энтропии веществ и т.д. Периодический закон охватывает более 20 свойств атомов, элементов, простых веществ и соединений.
Согласно квантовой механике, электрон может находиться в любой точке вокруг ядра атома как вблизи него, так и на значительном удалении. Поэтому границы атомов расплывчаты, неопределенны. В то же время в квантовой механике вычисляется вероятность распределения электронов вокруг ядра и положение максимума электронной плотности для каждой орбитали.
Орбитальный радиус атома (иона) – это расстояние от ядра до максимума электронной плотности наиболее удаленной внешней орбитали этого атома (иона).
Орбитальные радиусы (их значения приведены в справочнике) в периодах уменьшаются, т.к. увеличение числа электронов в атомах (ионах) не сопровождается появлением новых электронных слоев. Электронная оболочка атома или иона каждого последующего элемента в периоде по сравнению с предшествующим уплотняется из-за увеличения заряда ядра и увеличения притяжения электронов к ядру.
Орбитальные радиусы в группах увеличиваются, т.к. атом (ион) каждого элемента отличается от вышестоящего появлением нового электронного слоя.
Изменение орбитальных атомных радиусов для пяти периодов показано на рис. 13, из которого видно, что зависимость имеет характерный для периодического закона «пилообразный» вид.
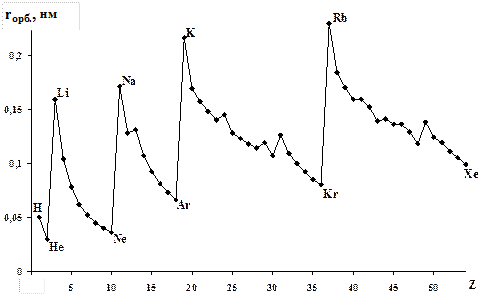
Рис. 13. Зависимость орбитального радиуса
от атомного номера элементов первого – пятого периодов.
Но в периодах уменьшение размеров атомов и ионов происходит не монотонно: у отдельных элементов наблюдаются небольшие «всплески» и «провалы». В «провалах» находятся, как правило, элементы, у которых электронная конфигурация соответствует состоянию повышенной стабильности: например, в третьем периоде это магний ([Nе]3s2), в четвертом – марганец ([Ar]4s23d5) и цинк ([Ar]4s23d10) и т.д.
Примечание. Расчеты орбитальных радиусов проводятся с середины семидесятых годов прошлого столетия благодаря развитию электронно-вычислительной техники. Ранее пользовались эффективными радиусами атомов и ионов, которые определяются из экспериментальных данных по межъядерным расстояниям в молекулах и кристаллах. При этом предполагается, что атомы представляют собой несжимаемые шары, которые соприкасаются своими поверхностями в соединениях. Эффективные радиусы, определяемые в ковалентных молекулах, называются ковалентными радиусами, в металлических кристаллах – металлическими радиусами, в соединениях с ионной связью – ионными радиусами. Эффективные радиусы отличаются от орбитальных, но их изменение в зависимости от атомного номера также является периодическим.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 3795; Нарушение авторских прав?; Мы поможем в написании вашей работы!