
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия и потенциал ионизации атомов
|
|
|
|
Энергией ионизации (Еион) называется энергия, затрачиваемая на отрыв электрона от атома и превращение атома в положительно заряженный ион.
Экспериментально ионизацию атомов проводят в электрическом поле, измеряя разность потенциалов, при которой происходит ионизация. Эта разность потенциалов называется ионизационным потенциалом (J). Единицей измерения ионизационного потенциала является эВ/атом, а энергии ионизации – кДж/моль; переход от одной величины к другой осуществляется по соотношению:
Еион = 96,5·J
Отрыв от атома первого электрона характеризуется первым ионизационным потенциалом (J1), второго – вторым (J2) и т.д. Последовательные потенциалы ионизации возрастают (табл. 1), так как каждый следующий электрон необходимо отрывать от иона с возрастающим на единицу положительным зарядом. Из табл. 1 видно, что у лития резкое увеличение ионизационного потенциала наблюдается для J2, у бериллия – для J3 , у бора – для J4 и т.д. Резкое увеличение J происходит тогда, когда заканчивается отрыв внешних электронов и следующий электрон находится на предвнешнем энергетическом уровне.
Т а б л и ц а 1
Потенциалы ионизации атомов (эВ/атом) элементов второго периода
| Элемент | J1 | J2 | J3 | J4 | J5 | J6 | J7 | J8 |
| Литий | 5,39 | 75,6 | 122,4 | – | – | – | – | – |
| Бериллий | 9,32 | 18,2 | 158,3 | 217,7 | – | – | – | – |
| Бор | 8,30 | 25,1 | 37,9 | 259,3 | 340,1 | – | – | – |
| Углерод | 11,26 | 24,4 | 47,9 | 64,5 | 392,0 | 489,8 | – | – |
| Азот | 14,53 | 29,6 | 47,5 | 77,4 | 97,9 | 551,9 | 666,8 | – |
| Кислород | 13,60 | 35,1 | 54,9 | 77,4 | 113,9 | 138,1 | 739,1 | 871,1 |
| Фтор | 17,40 | 35,0 | 62,7 | 87,2 | 114,2 | 157,1 | 185,1 | 953,6 |
| Неон | 21,60 | 41,1 | 63,0 | 97,0 | 126,3 | 157,9 |
Ионизационный потенциал является показателем «металличности» элемента: чем он меньше, тем легче отрывается электрон от атома и тем сильнее должны быть выражены металлические свойства элемента. Для элементов, с которых начинаются периоды (литий, натрий, калий и др.), первый ионизационный потенциал равен 4–5 эВ/атом, и эти элементы являются типичными металлами. У других металлов значения J1 больше, но не более 10 эВ/атом, а у неметаллов обычно больше 10 эВ/атом: у азота 14,53 эВ/атом, кислорода 13,60 эВ/атом и т.д.
Первые ионизационные потенциалы в периодах увеличиваются, а в группах уменьшаются (рис. 14), что свидетельствует об увеличении неметаллических свойств в периодах и металлических в группах. Поэтому неметаллы находятся в правой верхней части, а металлы – в левой нижней части периодической системы. Граница между металлами и неметаллами «размыта», т.к. большинство элементов обладают амфотерными (двойственными) свойствами. Тем не менее, такую условную границу можно провести, она показана в длинной (18-клеточной) форме периодической системы, которая имеется здесь в аудитории и в справочнике.
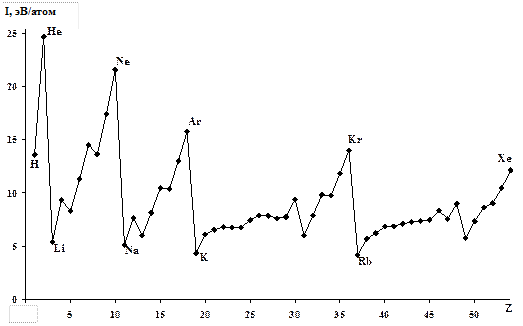
Рис. 14. Зависимость ионизационного потенциала
от атомного номера элементов первого – пятого периодов.
Пример 10. Ионизационный потенциал натрия равен 5,14 эВ/атом, а углерода 11,26 эВ/атом. Чему равна их энергия ионизации?
Решение. 1) Еион(Na) = 5,14·96,5 = 496,0 кДж/моль
2) Еион(С) = 11,26·96,5 = 1086,6 кДж/моль
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 5509; Нарушение авторских прав?; Мы поможем в написании вашей работы!