
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные характеристики химической связи
|
|
|
|
Типы химической связи
Химическая связь – это взаимодействие, которое связывает атомы в молекулы, ионы, кристаллы. Основным условием образования химической связи является понижение энергии многоатомной системы по сравнению с энергией изолированных атомов. Понижение энергии является результатом взаимодействия электрических полей, образуемых электронами тех атомов, которые участвуют в образовании химического соединения.
В зависимости от особенностей распределения электронной плотности между взаимодействующими атомами существуют три типа химической связи: ковалентная, ионная и металлическая. Каждый тип связи придает веществам характерные свойства. Например, кристаллические вещества с ковалентной связью (алмаз, кремний, бор и т.д.) отличаются твердостью, хрупкостью, термостойкостью, электроизоляционными свойствами, они не растворяются в воде. Вещества с ионной связью (NaCl, КBr, Nа2SO4 и т.д.) обычно тоже твердые, хрупкие, не проводят тока, но, как правило, растворяются в воде и эти растворы – электролиты. Металлические вещества (металлы и их сплавы) отличаются электро- и теплопроводностью и пластичны. Твердые вещества, образованные за счет межмолекулярного взаимодействия (сахар, парафин и т.д.) механически непрочны, легко плавятся и испаряются, хорошо растворяются, но их растворы – неэлектролиты.
Во многих веществах одновременно «присутствуют» несколько различных типов связи, например, в сульфате натрия – ионная связь между ионами Na+ и SO42- и ковалентная – между серой и кислородом в сульфат-ионах.
Основные характеристики химических связей – это длина, энергия и валентный угол.
Длиной химической связи (l св) называется расстояние между ядрами атомов в соединениях. В однотипных соединениях длина связи закономерно изменяется в согласии с изменением атомных радиусов, например, в молекулах галогеноводородов HF – HCl – HBr – HI длина связи возрастает, т.к. увеличивается радиус атомов в ряду F – Cl – Br – I.
Энергией связи (Есв) называется энергия, выделяющаяся при образовании химической связи или затрачиваемая на её разрыв. Молекулы распадаются при нагревании, действии электрических разрядов или радиации; по затраченной при этом энергии определяется энергия связи. В однотипных молекулах наблюдается зависимость между длиной и энергией связи: чем меньше длина связи, тем больше ее энергия, например:
Молекула HF HCl HBr HI
l св, нм 0,092 0,128 0,142 0,162
Есв, кДж/моль 566 432 366 298
Пример 1. Расположите в ряд по уменьшению энергии связи соединения углерода с галогенами.
Решение. Согласно закономерностям периодической системы, радиус атомов в группах, в том числе в ряду F – Cl – Br – I увеличивается, поэтому длина связи в ряду CF4 – CCl4 – CBr4 – CI4 тоже увеличивается, а поскольку молекулы однотипны, то энергия связи уменьшается. Этот вывод подтверждается опытными данными по энергии связи в молекулах (кДж/моль): CF4 –, CCl4 –, CBr4 –, CI4 –.
Валентным углом называется угол, образованный воображаемыми линиями, соединяющими центры атомов (рис. 1).

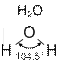

Рис. 1. Примеры молекул с различными валентными углами
Пример 2. Среди молекул Cl2, Br2, I2 укажите молекулу с наименьшей длиной и наибольшей энергией связи.
Решение. Согласно закономерностям периодической системы, радиус атомов в группах, в том числе в ряду Cl – Br – I увеличивается, следовательно, молекулой с наименьшей длиной и наибольшей энергией связи является молекула хлора Cl2. Этот вывод подтверждается опытными данными:
| Молекула | Cl2 | Br2 | I2 |
| Длина связи, нм | 0,199 | 0,228 | 0,267 |
| Энергия связи, кДж/моль | 242,3 | 192,9 | 151,0 |
Для объяснения механизма образования ковалентной химической связи разработано несколько методов (теорий). Наиболее общими являются метод валентных связей (метод ВС) и молекулярных орбиталей (метод МО).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 984; Нарушение авторских прав?; Мы поможем в написании вашей работы!