
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дативный механизм образования связи
|
|
|
|
Донорно-акцепторный механизм образования связи
При донорно-акцепторном механизме связывающие электронные пары образуются за счет объединения пары валентных электронов одного атома (донора) со свободной орбиталью другого атома (акцептора). Этот процесс сопровождается также перекрыванием двух атомных орбиталей, образованием области повышенной электронной плотности между ядрами атомов и понижением энергии электронов.
Классическим примером донорно-акцепторного механизма является образование катиона аммония NH4+ при взаимодействии аммиака с растворами кислот.
В молекуле аммиака имеется неподеленная пара валентных электронов, принадлежащая атому азота (см. рисунок), а в растворах кислот – катион водорода Н+ – частица со свободной орбиталью. Следовательно, молекула аммиака является донором электронной пары, а катион водорода – акцептором. Схема образования связи в катионе аммония по донорно-акцепторному механизму показана на рис. 9.

Рис. 9. Схема образования катиона аммония
В ионе NH4+ все связи равноценны по длине и энергии, несмотря на различие в механизме их образования (в исходных молекулах NH3 связи N–H образуются по обменному механизму).
Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать одновременно в роли и донора, и акцептора неподеленных пар электронов. Взаимодействие двух атомов, при котором каждый из них выступает в роли донора и акцептора электронных пар одновременно, называется дативным механизмом образования связи.
Классическим примером проявления дативного механизма является взаимодействие атомов хлора в молекуле Cl2, схема которого приведена на рис. 10.

Рис. 10. Схема образования молекулы хлора Cl2
 – связь, образующаяся по обменному механизму
– связь, образующаяся по обменному механизму
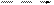 – связи, образующиеся по дативному механизму
– связи, образующиеся по дативному механизму
Действие дативного механизма связи приводит к увеличению прочности связи. Поэтому молекула хлора Cl2, несмотря на бóльшую длину связи, является более прочной (243 кДж/моль), чем молекула фтора F2 (159 кдж/моль), ковалентная связь в которой образуется только по обменному механизму.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 9485; Нарушение авторских прав?; Мы поможем в написании вашей работы!