
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы гибридизации
|
|
|
|
Чаще всего встречаются гибридизации sp, sp2, sp3 и sp3d2. Каждому типу гибридизации соответствует определенное пространственное строение молекул вещества.
sp-Гибридизация. Этот тип гибридизации наблюдается при образовании атомом двух связей за счет электронов, находящихся на s-орбитали и на одной p-орбитали (одного и того же энергетического уровня). При этом образуются две гибридные q-орбитали, направленные в противоположные стороны под углом 180 º (рис. 22).
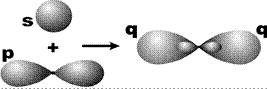
Рис. 22. Схема sp-гибридизации
При sp-гибридизации образуются линейные трехатомные молекулы типа АВ2, где А – центральный атом, у которого происходит гибридизация, а В – присоединенные атомы, у которых гибридизация не происходит. Такие молекулы образуются атомами бериллия, магния, а также атомами углерода в ацетилене (С2Н2) и в углекислом газе (СО2).
Пример 5. Объясните химическую связь в молекулах ВеН2 и ВеF2 и строение этих молекул.
Решение. Атомы бериллия в нормальном состоянии не образуют химических связей, т.к. не имеют неспаренных электронов (2s2). В возбужденном состоянии (2s12p1) электроны находятся на разных орбиталях, поэтому при образовании связей происходит sp-гибридизация по схеме, приведенной на рис. 22. К двум гибридным орбиталям присоединяются два атома водорода или фтора, как показано на рис. 23.
1)  2)
2) 
Рис. 23. Схема образования молекул ВеН2 (1) и ВеF2 (2)
Образующиеся молекулы – линейные, валентный угол 180º.
Пример 6. По экспериментальным данным молекула СО2 – линейная, причём, обе связи углерода с кислородом одинаковы по длине (0,116 нм) и энергии (800 кДж/моль). Как объясняются эти данные?
Решение. Эти данные о молекуле диоксида углерода объясняет следующая модель ее образования.
Атом углерода образует связи в возбужденном состоянии, при котором он имеет четыре неспаренных электрона: 2s12p3. При образовании связей происходит sp-гибридизация орбиталей. Гибридные орбитали направлены по прямой линии в противоположные стороны от ядра атома, а оставшиеся две чистые (негибридные) p-орбитали располагаются перпендикулярно друг к другу и к гибридным орбиталям. Все орбитали (гибридные и негибридные) содержат по одному неспаренному электрону.
Каждый атом кислорода, имеющий два неспаренных электрона на двух взаимно перпендикулярных p-орбиталях, присоединяется к атому углерода s-связью и p-связью: s-связь образуется с участием гибридной орбитали углерода, а p-связь образуется перекрыванием чистых p-орбиталей атомов углерода и кислорода. Образование связей в молекуле СО2 показано на рис. 24.
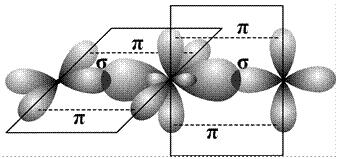
Рис. 24. Схема образования молекулы СО2
Кратность связи, равная двум, объясняет большую прочность связи, а sp-гибридизация – линейное строение молекулы.
Смешивание одной s- и двух p-орбиталей называется sp2-гибридизацией. При этой гибридизации получаются три равноценные q-орбитали, расположенные в одной плоскости под углом 120º (рис. 25).
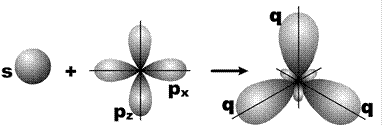
Рис. 25. Схема sp2-гибридизации
Образующиеся при этой гибридизации молекулы типа АВ3 имеют форму плоского правильного треугольника с атомами А в центре и атомами В в его вершинах. Такая гибридизация происходит в атомах бора и других элементов третьей группы и в атомах углерода в молекуле С2Н4 и в ионе СО32-.
Пример 7. Объясните образование химических связей в молекуле ВН3 и ее строение.
Решение. Экспериментальные исследования свидетельствуют о том, что в молекуле ВН3 все три связи В–Н расположены в одной плоскости, углы между связями равны 120º. Это строение молекулы объясняется тем, что в атоме бора в возбужденном состоянии смешиваются валентные орбитали, заселённые неспаренными электронами (2s12p2) и он образует связи sp2-гибридными орбиталями. Схема молекулы ВН3 приведена на рис. 26.
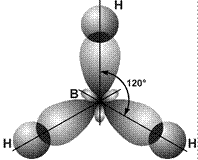
Рис. 26. Схема образования молекулы ВН3
Если в гибридизации участвуют одна s- и три p-орбитали (sp3-гибридизация), то в результате образуются четыре гибридные орбитали, направленне к вершинам тетраэдра, т.е. ориентированные под углами 109º28¢ (~109,5º) друг к другу. Образующиеся молекулы имеют тетраэдрическое строение. Гибридизацией этого типа объясняется строение предельных углеводородов, соединений углерода с галогенами, многих соединений кремния, катиона аммония NH4+ и др. Классическим примером этой гибридизации является молекула метана CH4 (рис. 27)
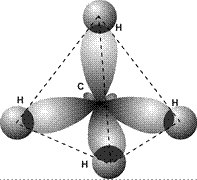
Рис. 27. Схема образования химических связей в молекуле СН4
Если в гибридизации участвуют одна s-, три p- и две d-орбитали (sp3d2- гибридизация), то возникают шесть гибридных орбиталей, напрвленных к вершинам октаэдра, т.е. ориентированных под углами 90º друг к другу. Образующиеся молекулы имеют октаэдрическое строение. Гибридизацией этого типа объясняется строение соединений серы, селена и теллура с галогенами, например SF6 и SeF6, и многих комплексных ионов: [SiF6]2–, [Fe(CN)6]3– и т.д. На рис. 28 показано образование молекулы гексафторида серы.
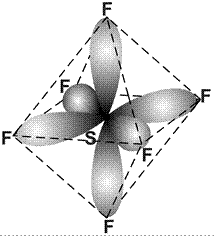
Рис. 28. Схема молекулы SF6
Химические связи с участием гибридных орбиталей отличаются большой прочностью. Если энергию s-связи, образованную «чистыми» s-орбиталями, принять за единицу, то энергия связи при sp-гибридизации будет равна 1,43, при sp2-гибридизации 1,99, при sp3-гибридизации 2,00, а при sp3d2-гибридизации 2,92. Увеличение прочности связей объясняется более полным перекрыванием гибридных орбиталей с негибридными при образовании химической связи.
Кроме рассмотренных типов гибридизации, в химических соединениях встречаются гибридизации sp2d, sp3d, sp3d3, sp3d3 и другие. При sp2d-гибридизации молекулы и ионы имеют квадратную форму, при sp3d-гибридизации – форму тригональной бипирамиды и при sp3d3-гибридизации – пентагональной бипирамиды. Другие типы гибридизации встречаются редко.
Пример 8. Приведены уравнения двух похожих реакций:
1) CF4 + 2HF = H2CF6; 2) SiF4 + 2HF = H2SiF6
Какая из них невозможна с точки зрения образования химических связей?
Решение. Для образования H2CF6 необходима sp3d2-гибридизация, но в атоме углерода валентные электроны находятся на втором энергетическом уровне, на котором нет d-орбиталей. Поэтому первая реакция в принципе невозможна. Вторая реакция возможна, так как sp3d2-гибридизация у кремния возможна.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 10395; Нарушение авторских прав?; Мы поможем в написании вашей работы!