
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Делокализованная связь
|
|
|
|
Во всех рассмотренных примерах электронная пара, обеспечивающая химическую связь, принадлежит только двум связанным атомам, т.е. электронная пара локализована. Но во многих случаях объяснение связи локализованными электронными парами противоречит опытным данным. Поэтому для объяснения химической связи часто используется понятие о подвижных или делокализованных электронах. Химическая связь, образуемая подвижными электронами, называется делокализованной. Такая связь имеется в молекуле HNO3, ионах CO32–, SO42–, PO43–, во многих органических соединениях. Классическим примером молекул с делокализованными связями является молекула бензола С6Н6.
В молекуле бензола шесть атомов углерода образуют правильный шестиугольник. Валентный угол 120º соответствует sp2-гибридизации орбиталей углерода. При этом две гибридные орбитали, расположенные под углом 120º, образуют связи с соседними атомами углерода, а третья присоединяет атом водорода. На рис. 18 показаны локализованные s-связи в этой молекуле (вид «сверху»).
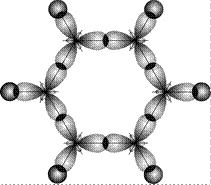
Рис. 18. Схема образования локализованных s-связей в молекулах бензола
В атоме углерода при sp2-гибридизации остается одна негибридная p-орбиталь, направленная перпендикулярно плоскости, в которой находятся гибридные орбитали. Перекрыванием боковых областей этих орбиталей в молекуле бензола образуются три p-связи.
Энергия связи между атомами углерода в этой молекуле равна 487 кДж/моль, т.е. имеет промежуточное значение между энергией одиночной связи С–С в этане (385 кДж/моль) и двойной связи С = С в этилене (592 кДж/моль). Это свидетельствует о том, что p-связи делокализованы: электроны p-связей движутся свободно по всему замкнутому шестиугольнику и «обслуживают» все шесть связей. На рис. 19 молекула С6Н6 показана «сбоку»: видны негибридные p-орбитали и делокализованная p-связь между ними.
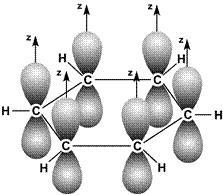
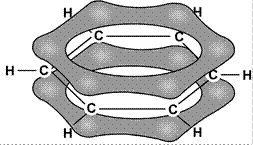
Рис. 19. Схема образования делокализованной p-связи в молекулах бензола
Таким образом, кратность связи между атомами углерода в молекуле С6Н6 равна 1,5 (одна s-связь и половина p-связи). Современное схематическое изображение бензольного кольца, в котором пунктиром показана делокализованная p-связь по всему кольцу, отличается от того, которое использовалось ранее (рис. 20)
1)  2)
2) 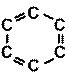
Рис. 20. Схематическое изображение бензольного кольца: 1 – современное, 2 – устаревшее
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4425; Нарушение авторских прав?; Мы поможем в написании вашей работы!