
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обменный механизм образования ковалентной связи
|
|
|
|
Существуют два механизма образования общих электронных пар: обменный и донорно-акцепторный.
При обменном механизме общие пары электронов образуются в результате спаривания неспаренных электронов, принадлежащих разным атомам. Само собой разумеется, что неспаренные электроны находятся на внешнем (валентном) энергетическом уровне.
Образование химических связей по обменному механизму можно наглядно иллюстрировать. Например, необходимо показать образование молекул водорода, фтора и азота.
Вначале рассматривается электронное строение атомов:
–водород (Н): 1s1 или (рис.3.1) – один неспаренный электрон;
–фтор (F): [He]2s22p5 или (рис. 3.2) – также один неспаренный электрон;
–азот (N):[He]2s22p3 или (рис. 3.3) – три неспаренных электронов.
1)  2)
2)  3)
3) 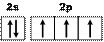
Рис.3. Электронно-графические схемы валентных электронов
атомов водорода (1), фтора (2) и азота (3)
Образование общих электронных пар в молекулах показано на рис. 4.
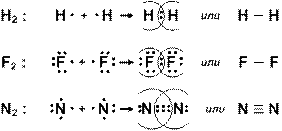
Рис.4. Образование общих электронных пар в молекулах водорода, фтора и азота
Из этого рисунка следует, что при образовании молекул каждый атом достраивает свою электронную оболочку до устойчивой электронной оболочки атома ближайшего в периодической системе благородного газа. Тем самым подтверждается гипотеза Льюиса об образовании ковалентной связи за счет обобществления электронов.
Но схемы рисунка 4 не отражают то, что общие электронные пары образуются при спаривании неспаренных электронов с противоположными значениями спиновых квантовых чисел. Поэтому для наглядного выражения обменного механизма чаще используются другие схемы, которые в некоторых учебных пособиях называются электронными схемами метода ВС. Для молекул водорода, фтора и азота они представлены на рис. 5.
1) 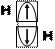 2)
2)  3)
3) 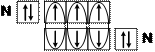
Рис. 5. Электронные схемы
молекул водорода (1), фтора (2) и азота (3) по методу валентных связей
В молекулах, состоящих из атомов разных элементов, образование общих электронных пар показано на рис. 6.

Рис. 6. Образование общих электронных пар в молекулах фтороводорода, воды и аммиака
При замене каждой общей электронной пары чёрточкой получаются структурные формулы:
| Формула | H2 | F2 | N2 | HCl | Н2О | NН3 |
| Структурная формула |
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1336; Нарушение авторских прав?; Мы поможем в написании вашей работы!