
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодические свойства соединений
|
|
|
|
Периодический закон распространяется на свойства однотипных соединений. Закономерно изменяются основно-кислотные свойства оксидов и гидроксидов: в периодах ослабляются основные свойства, но усиливаются кислотные свойства этих соединений, а в группах основные свойства, наоборот, усиливаются, а кислотные ослабляются. Например, элементы третьего периода образуют следующие оксиды: Na и Mg – основные, Al – амфотерный, а Si, P, S и Cl – кислотные. Элементы IIIA группы образуют такие оксиды: B – кислотный, Al, Ga, In – амфотерные, Tl – основный.
В периодах, как правило, увеличивается, а в группах уменьшается окислительная способность простых веществ и однотипных соединений.
У однотипных солей в периодах уменьшается термическая устойчивость и возрастает их склонность к гидролизу, а в группах наблюдается обратное.
При определении свойств химического элемента по его атомному номеру исходят из того, что атомный номер элемента (его порядковый номер в периодической системе) равен положительному заряду ядра и числу электронов в атоме. На этом основании записывается электронная формула элемента, находятся валентные электроны, определяется принадлежность к семейству и положение элемента в периодической системе: группа и подгруппа.
Если элемент принадлежит s-, d- или f-семействам, то он является металлом (кроме водорода и гелия), а если к p-элементам, то он может быть как металлом, так и неметаллом. Во втором периоде все p-элементы – неметаллы. В третьем периоде граница между металлами и неметаллами проходит между алюминием и кремнием, в четвертом сдвигается на одну клетку вправо, т.е. между германием и мышьяком, в пятом снова сдвигается на одну клетку, т.е. между сурьмой и теллуром, а в шестом – между полонием и астатом. Как уже говорилось на этой лекции, граница между металлами и неметаллами в 18-клеточной форме периодической системы обычно приводится.
По номеру группы, в которой находится элемент, можно указать высшую положительную степень окисления элемента в соединениях (она равна номеру группы) и высшую отрицательную степень окисления (она равна числу 8 за вычетом номера группы), написать формулы соответствующих соединений (оксида, галогенидов, соединений с водородом и металлами). Если положительная степень окисления равна +4 и более, то оксид обладает преимущественно кислотными свойствами (даже если он – оксид металла) и ему соответствует кислота, формулу которой также можно написать.
Для p-элементов обычно характерны несколько положительных степеней окисления, при этом они отличаются от высшей (в меньшую сторону) на число, кратное двум, следовательно, можно записать формулы соединений данного элемента не только в высшей, но и в других степенях окисления.
Периодическими являются многие другие свойства соединений: энергия химической связи, энтальпия и энергия Гиббса образования и др. Из этого следует:
место химического элемента в периодической системе определяет его свойства и свойства его многих соединений.
По мере усвоения химии глубина понимания периодического закона возрастает, и возможность предсказания состава и свойств соединений увеличивается.
Таким образом, периодический закон и периодическая система Д.И. Менделеева позволяют по атомному номеру дать общую характеристику химических свойств элемента, состав и свойства его важнейших соединений. Поистине «...периодическая система – это краткая физико-химическая энциклопедия» (акад. В.И. Гольданский).
Периодический закон и периодическая система элементов сыграли огромную роль в развитии науки и техники, и эта роль в настоящее время не уменьшается. На их основе проводятся исследования по открытию элементов, поиску их в природе, синтезу новых веществ.
Пример 13. Атомный номер химического элемента 33. Определите электронное строение его атома, место в периодической системе и его свойства.
Решение. Электронная формула элемента [Ar]3d104s24p3, следовательно, он принадлежит к семейству p-элементов. В атоме пять валентных электронов (4s24p3), находящихся на четвёртом энергетическом уровне. Поэтому элемент находится в четвертом периоде, в пятой группе, в главной подгруппе. В периодической системе находим название элемента и его символ: мышьяк As. Неметалл, но имеет слабые металлические свойства, поскольку находится около границы, разделяющей металлы и неметаллы. Высшая положительная степень окисления +5, высшая отрицательная –3, формулы соответствующих соединений As2O5, AsF5, AsH3, Na3As. Оксид As2O5 – кислотный, ему соответствуют мышьяковые кислоты: H3AsO4 (ортомышьяковая) и HAsO3 (метамышьяковая). Возможны соединения в степени окисления +3: As2O3, AsCl3, H3AsO3, HAsO2.
Пример 14. Пользуясь периодической системой элементов, напишите формулы высших оксидов хрома, марганца и олова и кислот, соответствующих этим оксидам
Решение. Хром расположен в шестой группе периодической системы, марганец в седьмой, а олово в четвертой. Номер группы указывает их максимальную валентность, следовательно требуемые формулы таковы:
Элементы: Cr Mn Sn
Оксиды: CrO3 Mn2O7 SnO2
Кислоты: H2CrO4 HMnO4 H2SnO3
Пример 15. Определите элемент пятого периода, высший оксид которого Э2O7, а с водородом этот элемент образует соединение HЭ.
Решение. Формула соединения данного элемента с кислородом свидетельствует о том, что он расположен в седьмой группе, следовательно, это может быть или технеций, или иод. Но газообразное соединение с водородом состава HЭ технеций (металл, d-элемент) не образует, следовательно, данный элемент – йод.
ЛЕКЦИЯ 4
Тема 5. Химическая связь и строение вещества
По этой теме необходимо знать и уметь следующее.
1.(32). Объяснять содержание основных характеристик химической связи (длина, энергия, валентный угол, дипольный момент) и закономерности изменения длины и энергии связи в однотипных молекулах: неорганических (HF–HCl––HBr–HI, H2O–H2S–H2Se–H2Te) и органических (C2H6–C2H4–C2H2).
2.(33). Объяснять причину образования ковалентной связи и её свойства (направленность, насыщаемость, полярность, неполярность, валентный угол, дипольный момент).
3.(34). Изображать схемами метода валентных связей обменный механизм образования химической связи в молекулах H2, N2, F2, HF, H2O, H2O2, NH3, CO2.
4.(35). Различать в молекулах N2 и CO2 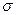 -связь и
-связь и 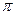 -связь, определять в них кратность химической связи; на примере молекул C2H6–C2H4–C2H2 и H2–N2 объяснять влияние кратности связи на ее энергию.
-связь, определять в них кратность химической связи; на примере молекул C2H6–C2H4–C2H2 и H2–N2 объяснять влияние кратности связи на ее энергию.
5.(36). Знать простейшие молекулы (CO) и ионы (NH 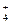 ), в которых химическая связь образуется по донорно-акцепторному механизму; определять в них степень окисления, стехиометрическую и электронную валентность элементов.
), в которых химическая связь образуется по донорно-акцепторному механизму; определять в них степень окисления, стехиометрическую и электронную валентность элементов.
6.(37). Знать и иллюстрировать примерами основные типы гибридизации (sp, sp2, sp3, sp3d2); определять тип гибридизации по геометрическому строению молекулы (иона) и значению валентного угла и, наоборот, знать геометрическое строение молекул (ионов), соответствующее определённому типу гибридизации (при отсутствии несвязывающих орбиталей).
7.(38). Объяснять влияние несвязывающих орбиталей на строение молекул аммиака и воды.
8.(39). Объяснять методом молекулярных орбиталей образование и свойства двухатомных молекул и молекулярных ионов, содержащих элементы первого и второго периодов периодической системы.
9.(40). Объяснять природу ионной связи; знать, между какими элементами она возникает и как она влияет на свойства веществ; объяснять закономерность изменения степени ионности в ряду однотипных соединений.
10.(41). Объяснять металлическую связь и её свойства теорией электронного газа.
11.(42). Знать, между какими молекулами образуется водородная связь и как она влияет на свойства соединений (температуру и энтальпию кипения, плотность, растворимость).
12.(43). Знать, между какими молекулами имеет место ориентационное, индукционное и дисперсионное взаимодействия и как они влияют на свойства соединений.
13.(44). Знать агрегатные состояния вещества (твердое, жидкое, газ, плазма) и как они отличаются по виду частиц и энергии связи между ними.
14.(45). Для твердого состояния знать классификацию кристаллов по виду частиц в узлах кристаллической решетки и типу взаимодействия межу ними (атомные, ионные, металлические, молекулярные) и характерные физико-химические свойства веществ с тем или иным типом кристаллов.
По теме «Химическая связь» читается две лекции. План первой лекции следующий.
1. Типы химической связи
2. Основные характеристики химической связи
3. Метод валентных связей
3.1. Основная причина образования ковалентной связи
3.2. Обменный механизм образования ковалентной связи
3.3. Кратность ковалентной связи
3.4. Типы перекрывания орбиталей
3.5. Донорно-акцепторный механизм образования связи
3.6. Дативный механизм образования связи
3.7. Насыщаемость и направленность ковалентной связи
3.8. Валентность в методе ВС
3.9. Делокализованная связь
4. Гибридизация орбиталей
4.1. Условия и закономерности гибридизации
4.2. Типы гибридизации
5. Влияние несвязывающих орбиталей на строение молекул
6. Достоинства и недостатки метода валентных связей
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1387; Нарушение авторских прав?; Мы поможем в написании вашей работы!