
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы перекрывания орбиталей
|
|
|
|
Кратность ковалентной связи
Кратностью химической связи в методе ВС называется число общих электронных пар, принадлежащих двум связанным атомам.
Например, в молекуле Н2, F2, HCl, H2O и NH3 кратность связей равна единице (одинарная связь) а в молекуле азота – трем (тройная связь). В молекулах органических соединений C2H6, C2H4 и C2H2 кратность химической связи между атомами углерода равна единице, двум и трём: Очевидно, что чем больше кратность химической связи, тем она прочнее, например:
| Молекула | 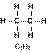
| 
| 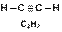
|
| Кратность связи атомов углерода | |||
| Энергия связи, кДж/моль |
При образовании химической связи атомные орбитали частично проникают одна в другую; этот процесс называется перекрыванием орбиталей. В результате перекрывания в пространстве между атомами увеличивается электронная плотность. На рис. 7 показано перекрывание орбиталей в молекулах водорода, фтора и фтороводорода.
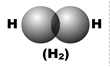
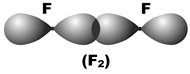

Рис. 7. Перекрывание электронных облаков в молекулах водорода, фтора и фтороводорода
Зона повышенной отрицательно заряженной электронной плотности (на рисунках она затемнена) притягивает к себе положительно заряженные ядра атомов (они обозначены точками), обеспечивая между ними химическую связь.
На рис. 7 атомные орбитали перекрываются по линии, соединяющей ядра атомов. Такое перекрывание обозначается символом s (сигма -связь). Сигма-связь возникает при перекрывании орбиталей s–s и s–p, а также орбиталей p–p, расположенных вдоль одной оси (примеры показаны на рис. 7). Кроме этого, сигма-связь возникает при перекрывании орбиталей s–d, а также орбиталей d–d, вытянутых вдоль одной оси, но такие случаи встречаются редко.
Атомные орбитали могут перекрываться по линии, перпендикулярной линии связи; такое перекрывание обозначается символом p (пи -связь). Классическим примером такого перекрывания орбиталей является молекула азота N2 с тройной связью, одна из которых s-связь, а две другие – p-связи (рис. 8)

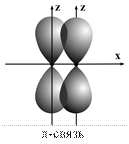

Рис. 8. Схема образования сигма (σ)- и пи (π)-cвязей в молекуле азота
Энергия σ-связи всегда больше энергии π-связи. Это означает, что π-связи могут возникать только как дополнительные к s-связи при кратности связи два или три.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 10535; Нарушение авторских прав?; Мы поможем в написании вашей работы!