
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Планирование и проведение лучевого лечения
|
|
|
|
Лучевая терапия, как метод лечения в клинической онкологии, для обеспечения гарантии качества требует проведения значительного количества последовательных диагностических процедур. Подготовка к облучению представляет собой сложную технологическую цепочку, исключение одного из звеньев которой неизбежно приводит к ухудшению результатов лечения.
Последовательность технологических этапов подготовки и проведения лучевой терапии может быть представлена следующим образом:
· Диагностика (верификация злокачественной опухоли, исключение отдаленных метастазов, оценка состояния систем и органов пациента);
· Клиническое планирование лечения с выбором способов лучевой терапии;
· Получение анатомо-топографической информации о степени и объеме распространения опухолевого процесса с использованием специальных исследований на компьютерном томографе, симуляторе, ультразвуковых установках и др. оборудовании
· Компьютерное дозиметрическое планирование сеансов облучения с выбором вида и энергии излучения, способов подведения дозы
· Разметка центров и конфигураций полей облучения на коже пациента
· Первичная укладка пациента на процедурном столе с использованием фиксирующих устройств, центраторов, световой имитации полей облучения
· Визуальная верификация зоны облучения с возможной коррекцией плана облучения
· Процедура облучения пациента
· Систематический мониторинг зоны и мишени облучения с возможной коррекцией плана облучения
· Оценка непосредственных результатов лечения
Лучевая терапия возможна только при соблюдении ряда основных принципов:
- Общих (сводятся к требованию равномерного облучения первичной опухоли и зон регионарного метастазирования в дозах, необходимых для полной регрессии опухолевых клеток при минимальном воздействии на окружающие здоровые органы и ткани;
- Специальных (отражают практические и научные достижения в лучевой терапии данного патологического процесса);
- О собых (определяют оптимальную тактику лечения конкретного пациента).
Все вышеуказанные технологические этапы распределяются по трем периодам, которые выделяют в курсе лучевой терапии: предлучевой, лучевой и постлучевой.
Предлучевой период. В этот период ведется подготовка больного к лучевой терапии. Проводится детальное исследование больного с целью уточнения основного диагноза, сопутствующих заболеваний и показаний к лучевому лечению. На этапе диагностики необходимо определить локализацию и распространенность опухолевого процесса, т.е. стадию по международной классификации TNM, а также уточнить морфологическую структуру опухолевых клеток. Затем выбирается планируемый режим фракционирования дозы и необходимые объемы облучения. Установлено, что толерантность к облучению уменьшается с увеличением облучаемого объема. Целью планирования является включение в зону облучения минимально возможного объема, но в то же время достаточного для воздействия на все опухолевые очаги. Исходя из этого, выделяют 4 различных объема облучения:
· Большой (видимый, определяемый) объем опухоли (БОО, gross tumor) включает видимую, визуализируемую средствами диагностики опухоль.
· Клинический объем мишени (КОМ) включает видимую опухоль в пределах предполагаемого субклинического (инфильтративного, лимфогенного) распространения.
· Планируемый объем мишени (ПОМ) включает КОМ и окружающие ткани с поправкой на вариации в размере, форме и положении клинического объема при его физиологическом движении (например, дыхательные экскурсии) относительно неподвижного лечебного пучка.
· Объем облучения (ОО) – это объем, облучение которого проводится в дозах с учетом толерантности нормальных тканей и особенностей формирующих пучок устройств. При лечении больных по методике трехмерного конформного облучения ПОМ и ОО совпадают.

Рис. 6.1. Опухолевые мишени, учитываемые при планировании облучения.
В настоящее время топометрическая подготовка больных к облучению выделена в самостоятельный раздел – клиническую топометрию. Клинической топометрией называют определение линейных размеров, площади, объема патологических образований, органов и анатомических структур, описание их взаимного расположения.
Основные принципы клинической топометрии состоят в следующем:
1. Строго индивидуальная для каждого больного топометрическая подготовка к облучению.
2. Исследование больного в положении тела, идентичном положению при планируемом облучении.
Если облучение намечают проводить в горизонтальном положении больного, лежа на спине или животе, то и данные соответственно для каждого положения должны быть получены раздельно для обоих положений тела больного. Исследования показали большие возможности смещения отдельных органов и их образований в зависимости от положения тела больного. Например, центр периферического рака в базальных отделах легкого изменяет свою проекцию на коже больного при изменении положении тела из вертикального в горизонтальное на 8-10 см и больше. При перемене положения из вертикального в горизонтальное, средостение расширяется от 0,5 см в верхних отделах до 2 см в нижних. Большие изменения наблюдаются и во время исследования пищевода в зависимости от положения тела больного на спине или на животе.
3. Максимальное приближение физиологического состояния больного во время исследования к состоянию во время облучения (интервал времени от приема пищи, мочеиспускания и т.д.). Выполнение этих условий обеспечивает равную степень наполнения полых органов и физиологического состояния организма.
4. Сочетание максимально возможной точности исследований с минимальной их обременительностью для больного и обслуживающего персонала. Из всей массы средств, способов и методов клинической топометрии должны быть выбраны только наиболее необходимые и дающие достаточную информацию.
Наиболее точные сведения для оценки размеров, положения опухоли относительно окружающих органов и глубины их залегания в теле пациента при планировании лучевой терапии позволяют получить компьютерные рентгеновский и магнитно-резонансный томографы. Учитывая то, что контрастность изображения на рентгеновской компьютерной томограмме определяется электронной плотностью тканей, которая, в свою очередь, жестко связана с их способностью поглощать (или пропускать) рентгеновское и гамма-излучение, при планировании лучевой терапии методу РКТ отдается предпочтение. Наиболее проста клиническая топометрия при разметке полей облучения и определении глубины опухоли для больных и для медицинского персонала при использовании рентгеновского симулятора (рис. 6.2).
|
|
Известно, что величина дозы, подводимой к объему мишени, ограничена толерантностью нормальных тканей. С другой стороны, для излечения опухоли необходимо сконцентрировать в опухоли достаточно большую дозу. На практике ограничение дозы и объема достигается за счет создания одного или более «ограничивающих изодозных» контуров. Топометрическая подготовка осуществляется лучевым терапевтом совместно с врачом-топометристом с помощью рентгеновского компьютерного томографа, МРТ, рентгеновского симулятора, УЗИ и других диагностических средств.
· РКТ (рис. 6.2. б) предназначен для получения необходимого числа томограмм на уровне мишени с определенным шагом в положении облучения пациента и передачи их в планирующую систему. На томограммах отображается пространственное расположение мишени и соседних органов, тканей, а также их размеры.
· Рентгеновский симулятор (рис. 6.2. а) – рентгенодиагностический аппарат, предназначенный для воспроизведения геометрических параметров (угла наклона гантри и коллиматора), разметки полей облучения в режиме имитации («симуляции») лучевой терапии.
В настоящее время предлучевая топометрическая подготовка производится на компьютерном томографе, при положении больного идентичном таковому во время лучевого лечения. РКТ-исследования, используемые в предлучевой подготовке, существенно отличаются от диагностических. Если в традиционной лучевой диагностике главной задачей является постановка диагноза, то при планировании лучевой терапии перед РКТ, наряду с диагностическими, стоят иные задачи. Это определение топографо-анатомических взаимоотношений опухоли и окружающих нормальных тканей, привязка положения опухоли и окружающих ее органов и тканей к накожным меткам, передача данных в компьютерную систему планирования дистанционного или контактного облучения, а также мониторинг эффективности лечения.
Практически каждый РКТ-сканер, используемый в предлучевой подготовке, может решать диагностические задачи. Но не любой диагностический компьютерный томограф может быть использован для планирования лучевой терапии. Поэтому радиотерапевтические отделения ведущих клиник оснащены собственными компьютерными томографами. Компьютерные томографы для лучевой терапии имеют увеличенный диаметр апертуры гантри (80 – 85 см), в то время как у диагностических сканеров диаметр апертуры обычно составляет 70 см. Первые имеют две заменяемые деки стола – вогнутую и плоскую, вторые – только вогнутую. Плоская дека соответствует конфигурации столов радиотерапевтических аппаратов. Увеличенный диаметр апертуры гантри вместе с расширенным полем обзора позволяют производить сканирование в том же положении пациента, в котором он будет облучаться, и получать при этом замкнутый контур тела. Необходимость визуализации контура тела пациента является еще одним отличием КТ- исследований для целей планирования лучевой терапии от диагностических исследований.
Полученные РКТ-сканограммы, с помеченными врачом-топометристом облучаемой мишенью и критическими органами, передаются на систему планирования.
Системы планирования предназначены для расчета программы облучения в виртуальной матрице электронной плотности. В специально программе (рис. 6.3.) медицинский физик совместно с лучевым терапевтом после просмотра всех РКТ-срезов предполагаемой области облучения (опухолевого очага и регионарных лимфатических узлов) выбирает вариант облучения, отвечающий требованиям конформности и предполагающий максимальный выигрыш в распределении дозы облучения между опухолью и здоровыми тканями. Большим преимуществом компьютерных систем планирования является возможность многократной оптимизации плана, в том числе уже во время лучевой терапии.

Рис. 6.3. Составление дозиметрического плана в системе планирования Cadplan. Расчет производится по компьютерной рентгеновской томограмме (аксиальный срез), соответствующей центру опухолевого очага.
По результатам расчета распечатывается анатомо-топографическая карта с изодозным распределением на ней – топографо-дозиметрический план лучевой терапии (рис. 6.4.).
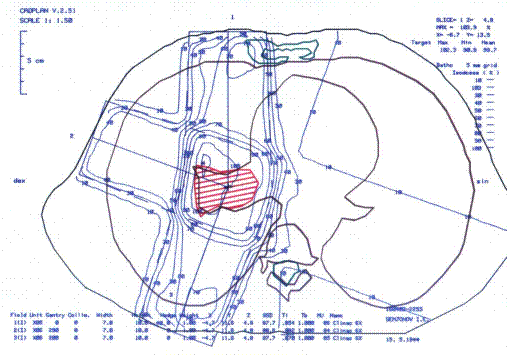
Рис. 6.4. Топографо-дозиметрический план ЛТ при центральном раке легкого.
После разметки центров и конфигурации полей облучения на коже пациента, проводится визуальная верификация зоны облучения с коррекцией составленного плана облучения. Эту процедуру возможно осуществлять на специальном рентгеновском симуляторе. При облучении на дистанционных гамма-терапевтических аппаратах используют гаммаграфический контроль. При наличии современного оборудования и системы «отображения пучка в реальном времени» делают «портальные снимки» в пучке излучения (рис. 4.9., стр. 65).
Лучевой период. Длительность лучевого периода зависит от выбранного курса лечения и составляет от 2 до 8 недель. Максимально эффективным режимом фракционирования, позволяющим подвести к опухоли значительные дозы ионизирующего излучения при максимальном щажении здоровых тканей, считается режим традиционного (классического, конвенциального) облучения. Этот режим заключается в ежедневном облучении опухоли в разовой дозе 1,8-2,5 Гр. Суммарная доза при радикальном облучении должна составлять не менее 60 Гр.
Технологическое обеспечение процедуры облучения включает тщательную укладку больного в соответствии с проведенной разметкой полей облучения и обозначением других ориентиров на коже больного; подробное описание всех технических параметров пучка излучения и перемещений головки аппарата и терапевтического стола с целью наиболее точного наведения пучка на мишень; подбор готовых принадлежностей, формирующих поле облучения; изготовление индивидуальных фигурных защитных блоков.
Обеспечение гарантии качества лучевого лечения диктует необходимость строгого выполнения выбранного плана во время каждой процедуры облучения, то есть обеспечения по возможности максимально точного воспроизведения каждой последующей укладки после первичной. Для этого в процессе лучевого лечения периодически проводят «мониторинг» зоны облучения для определения динамики опухоли с использованием как стандартных диагностических средств, так и, чаще, симулятора и РКТ.
С целью минимизации воздействия на здоровые окружающие ткани в случае облучения до высокой дозы, превышающей 50 Гр, в обязательном порядке сокращают объемы облучения до, как правило, первичных размеров опухолевого очага. Добавочную дозу на первичную опухоль после ее облучения в пределах регионарного лимфоколлектора часто подводят укрупненными фракциями методом контактной, либо дистанционной лучевой терапии. Такое добавочное облучение принято называть бустом (от английского boost – добавка, поддержка, увеличение).
Послелучевой период. Это время от момента окончания курса лучевой терапии до окончания лучевой реакции (обычно 6-8 недель). В этот период продолжается симптоматическая и общеукрепляющая терапия. Оценка непосредственных, или первичных, результатов лечения проводится полуколичественным методом по рекомендациям экспертов ВОЗ, общим для любых терапевтических противоопухолевых воздействий. Различают следующие первичные эффекты:
· Полная регрессия – полное разрушение опухолевого очага либо очагов.
· Частичная регрессия – уменьшение опухолевых очагов более чем на 50% от их первоначальных размеров.
· Стабилизация – регрессия опухолевых очагов менее 50% или их увеличение менее чем на 25%.
· Прогрессирование – увеличение размеров опухолевых очагов более чем на 25% или появление новых опухолевых очагов.
Первичный эффект лечения чаще всего считают наиболее весомым критерием прогноза отдаленной выживаемости больных. Лучевое лечение считается эффективным при достижении полной или частичной регрессии. Долговременная выживаемость онкологических больных возможна только при значительном уменьшении, либо исчезновении опухоли после лечения. Иногда для оценки непосредственной эффективности лечения группы больных в клинических исследованиях по лучевой терапии применяют понятие объективный эффект, представляющий собой сумму частот полной и частичной регрессии.
Контрольные вопросы к разделу
(выделены правильные ответы)
1) Основным общим принципом лучевой терапии злокачественных опухолей является…
а) Облучение первичной опухоли и регионарных лимфатических узлов до максимальной дозы, необходимой для полного разрушения злокачественного роста;
б) Облучение первичной опухоли, клинически видимых регионарных и отдаленных метастазов до максимальной дозы, необходимой для полного разрушения злокачественного роста;
в) Облучение зон опухолевого поражения (первичной опухоли и регионарных лимфатических узлов) до оптимальной дозы, предусматривающей минимальное поражение окружающих здоровых органов и тканей;
г) Подведение оптимальных доз облучения на очаги первичного поражения, регионарные лимфоузлы и отдаленные метастазы, позволяющих повысить вероятность их поражения при умеренном риске повреждения нормальных тканей
2) Планируемый объем мишени включает…
а) видимую, визуализируемую средствами диагностики, опухоль;
б) включает видимую опухоль в пределах предполагаемого субклинического (инфильтративного, лимфогенного) распространения
в) включает видимую опухоль в пределах предполагаемого субклинического (инфильтративного, лимфогенного) распространения с поправкой на вариации в размере, форме и положении клинического объема при его физиологическом движении
г) включает видимую опухоль в пределах предполагаемого субклинического (инфильтративного, лимфогенного) и гематогенного метастатического распространения с поправкой на вариации в размере, форме и положении клинического объема при его физиологическом движении
3) Принципами клинической топометрии являются…
а) Исследование больного в положении тела, идентичном положению при планируемом облучении.
б) Максимальное приближение физиологического состояния больного во время исследования к состоянию во время облучения.
в) Сочетание максимально возможной точности исследований с минимальной их обременительностью для больного и обслуживающего персонала.
г) Все перечисленное
4) Топометрическая подготовка осуществляется с помощью…
а) гамма-терапевтической установки
б) рентгеновского компьютерного томографа
в) рентгеновского симулятора
г) систем визуализации опухоли в режиме реального времени
5) В задачи топометрии с использованием рентгеновского компьютерного томографа входит…
а) определение топографо-анатомических взаимоотношений опухоли и окружающих нормальных тканей
б) исключение отдаленных метастазов
в) привязка положения опухоли и окружающих ее органов и тканей к накожным меткам
г) мониторинг эффективности лечения
6) Что такое топографо-дозиметрический план?
а) Суммарное изодозное распределение
б) Дозиметрическая характеристика процедуры облучения
в) Анатомо-топографическая карта (срез тела больного на уровне опухолевого поражения) с отраженным на ней изодозным распределением
г) Дозиметрический план процедуры облучения
7) Какие разовые очаговые дозы используют при традиционном (конвенциальном) режиме фракционирования?
а) 3-4 Гр
б) 5 Гр
в) 6,5 Гр
г) 1,8-2,5 Гр
д) 1 Гр
8) Какая суммарная очаговая доза необходима при лечении злокачественных опухолей с радикальной целью (в режиме традиционного фракционирования)?
а) 30 – 40 Гр
б) 50 – 60 Гр
в) Более 60 Гр
г) 44 – 50 Гр
9) Сокращение объемов облучения с целью минимизации воздействия на здоровые окружающие ткани до первичных размеров опухолевого очага проводят…
а) по достижении суммарной дозы 20 Гр
б) по достижении суммарной дозы 30 Гр
в) по достижении суммарной дозы 50 Гр
г) сокращение нецелесообразно в связи с высокой радиорезистентностью метастазов в регионарных лимфатических узлах
10) Что называют «стабилизацией» опухолевого процесса при оценке непосредственных результатов лечения?
а) Регрессия опухолевых очагов более чем на 50% от их первоначальных размеров
б) Регрессия опухоли на 30% или увеличение на 30%
в) Регрессия опухолевых очагов менее 50% или их увеличение менее чем на 25%
г) Увеличение размеров опухолевых очагов более чем на 25% или появление новых опухолевых очагов.
д) Регрессия опухолевых очагов более 60% или их увеличение на 10%
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 7512; Нарушение авторских прав?; Мы поможем в написании вашей работы!