
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Моль. Эквиваленты и молярные массы эквивалентов простых и сложных веществ. Закон эквивалентов 1 страница
|
|
|
|
Пример 1. 0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля.
Решение. Эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в обменных реакциях или одному электрону в окислительно-восстановительных.
Масса одного эквивалента называется молярной массой эквивалента. Задачу решают по закону эквивалентов: «Массы (объемы) реагирующих друг с другом веществ пропорциональны молярным массам эквивалентов (объемам)»:
m1: m2 = Мэкв.1 : Мэкв.2.
В условии задачи количество выделившегося водорода дано в объемных единицах. Поэтому в выражении закона эквивалентов масса и молярная масса эквивалента газа заменяются объемом и молярным объемом эквивалента:
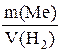 =
=  .
.
Молярный объем эквивалента водорода (объем, занимаемый молярной массой эквивалента газа при нормальных условиях):
22,4: 2 = 11,2 л/моль.
Рассчитываем молярную массу эквивалента металла:
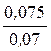 =
=  , Мэкв.(Me)=
, Мэкв.(Me)=  = 12 г/моль.
= 12 г/моль.
Зная молярную массу эквивалента металла, по закону эквивалентов можно определить молярную массу эквивалента никеля:
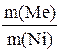 =
= 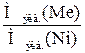 ,
, 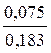 =
=  ,
,
Мэкв.(Ni)= 
 = 29,35 г/моль.
= 29,35 г/моль.
Пример 2. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида.
Решение. Чтобы определить, какой металл был сожжен, рассчитаем молярную массу его эквивалента по закону эквивалентов:
 =
=  , Мэкв.(Ме)=
, Мэкв.(Ме)= 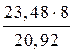 = 9 г/моль.
= 9 г/моль.
Молярная масса эквивалента кислорода равна 8 г/моль, а массу соединившегося с металлом кислорода определяем из соотношения:
m(Me2O3) = m(Me) + m(O2), m(O2) = 44,40 – 23,48 = 20,92 г.
Из формулы A(Me) = Мэкв.(Me) · n рассчитываем атомную массу металла:
AMe= 9 · 3 = 27 г.
По Периодической системе Д. И. Менделеева определяем, что металл с атомной массой 27 – алюминий. Формула оксида алюминия Al2O3. Его молярная масса эквивалента:
Мэкв.(Al2O3) = Мэкв.(Al) + Мэкв.(O2);
Мэкв.(Al2O3) = 9 + 8 = 17 г/моль.
Пример 3. Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
1. H2SO4 + 2NaOH = Na2SO4 + 2H2O.
2. 2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O.
3. Al(OH)3 + 3NaCl = AlCl3 + 3NaOH.
4. Zn(OH)2 + NaCl = ZnOHCl + NaOH.
Решение. Решение. Молярные массы эквивалентов сложных веществ могут иметь различные значения (в зависимости от реакции, в которую они вступают).
Молярная масса эквивалента кислоты (гидроксида) равна ее молекулярной массе, деленной на количество атомов водорода (для гидроксида на количество OH- групп), замещенных в данной реакции другими атомами или ионами.
В первой реакции в молекуле серной кислоты 2 атома водорода замещаются на металл, во второй – 1 атом водорода фосфорной кислоты замещается на металл, поэтому
Мэкв.(H2SO4) =  =
= 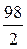 ,
,
Мэкв.(H2SO4) = 49 г/моль.
Мэкв.(Н3PO4) =  =
=  ,
,
Мэкв.(H3PO4) = 98 г/моль.
Соответственно в 3-й и 4-й реакциях в гидроксидах замещаются на хлорид- ионы три и одна гидроксогруппы соответственно, и их молярные массы эквивалентов равны:
Мэкв.[Al(OH)3] = 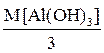 =
=  = 26 г/моль,
= 26 г/моль,
Мэкв.[Zn(OH)2] =  =
= 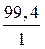 = 99,4 г/моль.
= 99,4 г/моль.
Пример 4. На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции.
Решение. Молярную массу эквивалента дигидрофосфата калия можно рассчитать по закону эквивалентов:
 =
= 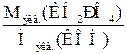 ,
,
Мэкв.(KH2PO4) =  .
.
Молярная масса эквивалента гидроксида калия рассчитывается из соотношения (пример 1.3):
Мэкв.(KOH) =  =
= 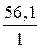 = 56,1 г/моль,
= 56,1 г/моль,
Мэкв.(KH2PO4) = 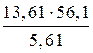 = 136,1 г/моль.
= 136,1 г/моль.
Чтобы написать уравнения реакции, необходимо рассчитать число молей дигидрофосфата калия, вступивших в реакцию. Для этого разделим молекулярную массу дигидрофосфата калия на его молярную массу эквивалента:

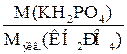 =
=  =1 моль.
=1 моль.
Уравнение реакции имеет вид
KH2PO4 + KOH = K2HPO4 + H2O.
Задания
1. Определите эквивалент и молярную массу эквивалента фосфора, кислорода и брома в соединениях PH3, H2O, HBr.
2. Молярная масса эквивалента трехвалентного металла равна 9 г/моль. Вычислите мольную и атомную массу металла, молярную массу эквивалента его оксида и процентное содержание кислорода в оксиде.
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента металла. Ответ: 32,5 г/моль.
4. Укажите, с какими из нижеперечисленных веществ могут взаимодействовать кислотные оксиды: *
1) вода, 2) кислота, 3) основание, 4) амфотерный оксид,
5) амфотерный гидроксид.
5. Укажите, с какими из нижеперечисленных веществ могут взаимодействовать основные оксиды: *
1) вода, 2) кислота, 3) основание, 4) кислотный оксид, 5) основной оксид, 6) амфотерный оксид.
6. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите молярную массу эквивалента, мольную массу и атомную массу этого элемента.
7. Укажите все соли, которые можно получить при взаимодействии гидроксида калия с серной кислотой:*
1) гидросульфат, 2) сульфат, 3) гидроксосульфат, 4) ди-гидроксосульфат.
8. Укажите все соли, которые можно получить при взаимодействии гидроксида алюминия с серной кислотой: *
9. Выразите в молях: а) 6,02×1022 молекул С2Н2; б) 1,80×1014 атомов N2; в) 3,01×1023 молекул NH3. Чему равна мольная масса указанных веществ?
10. Вычислите эквивалент и молярную массу эквивалента Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
11. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярные массы эквивалента металла и его оксида. Чему равна мольная и атомная масса этого металла?
12. 3,04 г некоторого металла вытесняют 0,252 г водорода,
26,965 г серебра и 15,885 г меди из соединений этих элементов. Вычислите молярные массы эквивалентов указанных металлов.
Ответ: 12,16 г/моль, 107,86 г/моль, 63,54 г/моль.
13. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид; б) гидроксохлорид; в) трихлорид. Вычислите эквивалент и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций.
14. Избытком гидроксида калия подействовали на растворы:
а) дигидрофосфата калия; б) дигидроксонитрата висмута(III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и молярные массы эквивалентов.
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) гидроксодихлорида алюминия. Напишите уравнения реакций этих веществ с НСl и определите их эквиваленты и молярные массы эквивалентов.
16. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н. у.). Вычислите молярную массу эквивалента, мольную массу и атомную массу металла.
17. Какой объем при н. у. занимает молярная масса эквивалента кислорода? Вычислите мольную и атомную массу двухвалентного металла, если на окисление 6,34 г этого металла пошло 0,68 л кислорода (н. у.).
18. На нейтрализацию 0,943 г фосфористой кислоты Н3РОз израсходовано 1,291 г КОН. Вычислите эквивалент, молярную массу эквивалента и основность кислоты. Ответ: 0,5 моль, 41 г/моль, 2.
19. Укажите, какие из нижеперечисленных веществ реагируют с водой:*
1) углекислый газ, 2) оксид кальция, 3) серный ангидрид,
4) хлороводород, 5) аммиак, 6) азот, 7) медь, 8) натрий.
20. Укажите все соли, которые можно получить при взаимодействии гидроксида кальция и серной кислоты:*
1) гидросульфат, 2) сульфат, 3) гидроксосульфат, 4) ди-гидроксосульфат.
* Составьте уравнения соответствующих реакций.
1.2. Строение атома
Пример 1. Определите количество протонов и нейтронов в ядре атома платины.
Решение. Символ ядра атома обозначается символом соответствующего элемента. Слева вверху над символом указывается массовое число (А), слева внизу - заряд атома (Z), численно равный порядковому номеру элемента.
Согласно современным представлениям, ядро атома состоит из положительно заряженных протонов (p) и не обладающих электрическим зарядом нейтронов (n). Массовое число атома и есть сумма протонов и нейтронов. Число протонов равно порядковому номеру элемента (т. е. его положительному заряду), тогда количество нейтронов находим по разности между массовым числом и порядковым номером элемента: A - Z = N.
Для платины с зарядом ядра 78 число протонов равно 78, а число нейтронов рассчитываем по разности атомной массы и заряда ядра атома:
195 - 78 = 117.  Pt (78 p, 117 n).
Pt (78 p, 117 n).
Пример 2. Электрон в атоме характеризуется набором квантовых чисел: n = 3, l = 1, m l = 0. Какая форма записи отражает энергетическое состояние электрона?
Решение. Квантовая химия атомов и молекул состояние каждого электрона описывает волновой функцией y, называемой атомной орбиталью и характеризуемой набором квантовых чисел. Волновая функция y выводится из уравнения Шредингера, а квантовые числа входят в это уравнения в виде целочисленных параметров. Квантовые числа принимают следующие значения:
n = 1, 2, 3, 4, …7;
l = 0, 1,2, 3, … (n - 1);
m l = 0, 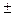 1,
1, 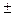 2, …
2, … 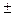 l;
l;
ms = 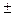 1/2.
1/2.
Главное квантовое число n характеризует энергию электрона на энергетическом уровне и размер электронного облака, орбитали. При
n = 3 электрон находится на третьем энергетическом уровне. При записи электронной формулы главное квантовое число пишется цифрой.
Орбитальное квантовое число l характеризует энергию электрона на энергетическом подуровне, определяет значение орбитального момента количества движения электрона и форму электронного облака. Орбитальное квантовое число при записи электронной формулы пишется буквой. При l = 0, s-подуровень; l = 1, p-подуровень; l = 2,
d-подуровень; l = 3, f-подуровень. Соответственно электроны этих подуровней называются s-, p-, d-, f-электронами. По условию задачи l = 1, это p-электрон.
Магнитное квантовое число m l определяет пространственную ориентацию атомной орбитали в магнитном поле и принимает при данном l – (2 l + 1) значений. s-состоянию (l = 0) отвечает всегда только одна орбиталь; p-состоянию (l = 1) - три орбитали с одинаковой энергией; d-состоянию (l = 2) - пять орбиталей и f-состоянию (l = 3) - семь орбиталей с одинаковой энергией. В условии задачи l = 1, этому состоянию отвечают три орбитали: px, py, pz, соответственно координатным осям.
Итак, запись, отражающая энергетическое состояние электрона при n = 3, l = 1, m l = 0, будет иметь вид 3pz.
Четыре квантовых числа полностью характеризуют состояние электрона в атоме. Они определяют энергию электрона, его размер и форму, спиновой момент количества движения электрона. При переходе электрона с одной орбитали на другую меняются квантовые числа, соответственно меняется состояние электрона в атоме.
Пример 3. Какой энергетический подуровень заполняется электронами раньше: 5s или 4d; 6s или 5p и почему?
Решение. Заполнение электронами энергетических уровней и подуровней подчиняется принципу «минимума энергии», т. е. вначале заполняются орбитали с меньшей энергией. Энергетическое состояние электрона характеризуется главным и орбитальным квантовыми числами и заполнение орбиталей происходит в последовательности увеличения их суммы (n + l). Для 5s-орбитали эта сумма равна 5 + 0 = 5, а для 4d-орбитали
4 + 2 = 6. Поэтому 5s- орбиталь заполняется электронами раньше.
Если сумма главного и орбитального квантовых чисел для двух орбиталей одинакова, то раньше заполняется та, у которой меньше значение главного квантового числа. Так, для 6s- и 5d-орбиталей эти суммы одинаковы (6 + 0 = 6 и 5 + 1 = 6), поэтому вначале заполняется 5p-орбиталь, а потом 6s.
Пример 4. Составьте электронные формулы атомов элементов № 20 и № 53. На каких энергетических уровнях и подуровнях находятся валентные электроны?
Решение. Порядковый номер элемента, равный заряду ядра атома, указывает число электронов в структуре атома. Согласно принципу «минимума энергии» (см. пример 2.4) заполнение электронами энергетических уровней и подуровней идет в следующем порядке:
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, (5d1), 4f14,
5d2 - 10, 6p6, 7s2, (6d1 - 2), 5f14, 6d3 - 10, 7p.
Цифрой указывается значение главного квантового числа n – энергетический уровень, буквой - значение орбитального квантового числа l - энергетический подуровень. Индекс справа вверху показывает число электронов на данном подуровне. Суммарное число индексов должно совпадать с числом электронов в атоме, т. е. с его порядковым номером. При записи электронной формулы используют только главное и орбитальное квантовые числа.
Электронные формулы атомов элементов № 20 и № 53 имеют вид:
№ 20 (Ca) - 1s2, 2s2, 2p6, 3s2, 3p6, 4s2 ,
№ 53 (I) - 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p5.
Валентные электроны в атоме расположены на последнем энергетическом уровне и на заполняющемся подуровне. У Ca это 4s2, у
I - 5s2 5p5. Поскольку в атоме кальция последним заполняется электронами s-подуровень, то он относится к семейству s-элементов, а I - к семейству p-элементов.
Пример 5. Определите, каким элементам соответствуют приведенные электронные структуры:
а) …. 4s2 3d6,
б) …. 6s2 5d1 4f7,
в) …. 5s2 4d10 5p2?
Решение. В электронной формуле главное квантовое число n (пишется цифрой) определяет энергетический уровень и совпадает с номером периода в периодической таблице Д. И. Менделеева. Число валентных электронов (электроны последнего энергетического уровня) равно номеру группы, в котором находится элемент.
В примере 2а n = 4, следовательно, элемент находится в четвертом периоде. Число валентных электронов (показатель степени в электронной формуле) равно 2 + 6 = 8, т. е. элемент расположен в восьмой группе - это железо.
В примере 2б n = 6, элемент шестого период, в атоме заполняется электронами f-подуровень (7 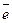 ) при частично заполненном d-подуровне (1
) при частично заполненном d-подуровне (1 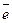 ). Один электрон на d-подуровне имеет лантан № 57, за ним в таблице расположены лантаноиды (№ 58-71, f-элементы) и семь электронов на f-подуровне у гадолиния.
). Один электрон на d-подуровне имеет лантан № 57, за ним в таблице расположены лантаноиды (№ 58-71, f-элементы) и семь электронов на f-подуровне у гадолиния.
В примере 2в n = 5, элемент пятого периода. Валентные электроны 2 + 2 = 4, т. е. это элемент четвертой группы - олово.
Пример 6. Заряды ядер элементов в периодической системе непрерывно увеличиваются, а свойства простых веществ повторяются периодически. Как это объяснить?
Решение. Д. И. Менделеев заметил, что свойства элементов периодически повторяются с возрастанием значений их массовых чисел. Он расположил открытые к тому времени 63 элемента в порядке увеличения их атомных масс с учетом химических и физических свойств. Менделеев считал, что открытый им периодический закон является отражением глубоких закономерностей во внутреннем строении вещества, он констатировал факт периодических изменений свойств элементов, но причины периодичности не знал.
Дальнейшее изучение строения атома показало, что свойства веществ зависят от заряда ядра атомов, и элементы можно систематизировать, основываясь на их электронной структуре. Свойства простых веществ и их соединений зависят от периодически повторяющейся электронной структуры атомов и «электронные аналоги» являются также и «химическими аналогами».
Распишем электронные формулы атомов элементов главных подгрупп второй и седьмой групп.
Элементы второй группы имеют общую электронную формулу валентных электронов ns2. Распишем их электронные формулы:
Be 1s2 2s2,
Mg 1s2 2s2 2p6 3s2,
Ca 1s2 2s2 2p6 3s2 3p6 4s2,
Sr 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2.
У элементов седьмой группы общая электронная формула валентных электронов ns2 np5, а полные электронные формулы имеют вид:
F 1s2 2s2 2p5,
Cl 1s2 2s2 2p6 3s2 3p5,
Br 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5,
I 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5.
Итак, электронные структуры атомов периодически повторяются у элементов одной группы, поэтому периодически повторяются и их свойства, так как они зависят в основном от электронного строения валентных электронов. Элементы одной группы имеют общие свойства, но есть и отличия. Это можно объяснить тем, что хотя атомы и имеют одинаковую электронную структуру валентных электронов, но эти электроны расположены на разном расстоянии от ядра, сила притяжения их к ядру при переходе от периода к периоду ослабевает, они становятся более подвижными, что отражается на свойствах веществ.
Задания
21. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
22. Напишите электронные формулы атомов фосфора и ванадия. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
23. Какое максимальное число электронов может занимать s-, p-, d- и f-орбитали данного энергетического уровня? Почему?
24. Напишите электронные формулы атомов марганца и селена. К какому электронному семейству относится каждый из этих элементов?
25. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Составьте электронную формулу атома элемента с порядковым номером 21.
26. Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 29. У последнего происходит провал одного 4s-электрона на 3d-подуровень. К какому электронному семейству относится каждый из этих элементов?
27. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
28. Сколько и какие значения может принимать магнитное квантовое число m l при орбитальном квантовом числе l = 0; 1; 2 и 3? Какие элементы в периодической системе носят название s-, р-, d- и f-элементов? Приведите примеры.
29. Какие значения могут принимать квантовые числа n, l, ml и ms, характеризующие состояние электронов в атоме. Какие значения они принимают для внешних электронов атома магния?
30. Значения какого квантового числа определяют число s-, p-, d- и
f-орбиталей на энергетическом уровне? Сколько всего s-, p- и d-электронов в атоме кобальта?
31. В чем заключается принцип несовместимости Паули? Может ли быть на каком-нибудь подуровне атома p7 или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
32. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера? Почему?
33. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера?
34. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
35. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется химический характер этих соединений при переходе от натрия к хлору?
36. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
37. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос; какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Сd(ОН)2 или Sr(OH)2?
38. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
39. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда, как свойства простых тел изменяются периодически. Чем это можно объяснить?
40. Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
1.3. Химическая связь и строение молекул.
Конденсированное состояние вещества
Пример 1. Исходя из теории ковалентной связи, изобразите в виде валентных схем строение молекул: HCl, H2O, NH3.
Решение. Согласно методу валентных схем (метод ВС), ковалентная связь образуется путем перекрывания электронных облаков неспаренных электронов. Эта связь двухэлектронная, двуцентровая.
Выпишем валентные электроны атомов, образующих указанные молекулы, и распределим их по орбиталям:
H 1s1,
Cl 2s2 2p5,
O 2s2 2p4,
N 2s2 2p3.
При образовании молекулы HCl происходит перекрывание неспаренных s-электрона атома водорода и p-электрона атома хлора:
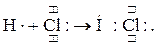
В молекуле воды перекрываются два неспаренных p-электрона атома кислорода и два s-электрона атомов водорода:

И, наконец, в молекуле аммиака три неспаренных p-электрона атома азота перекрываются с тремя s-электронами атомов водорода:
Н
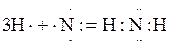 .
.
Во всех трех случаях у атомов при обобществлении электронов происходит достройка внешнего энергетического уровня до устойчивой двухэлектронной (гелиевой) конфигурации у атомов водорода или восьмиэлектронной (неоновой) у атомов кислорода и азота.
Пример 2. Почему энергия двойной связи С = С (613,2 кДж) не равна удвоенному значению энергии одинарной связи С - С (348,6 кДж)?
Решение. Энергия связи в значительной мере зависит от способа перекрывания электронных облаков при образовании связи. Если область перекрывания лежит на линии связи - это s-связь. Если область перекрывания электронных облаков перпендикулярна линии связи, то это p-связь. s- и p-связи неравноценны по энергии, прочнее s-связь.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 2813; Нарушение авторских прав?; Мы поможем в написании вашей работы!