
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие свойства металлов
|
|
|
|
Пример 1. К какому классу соединений относятся вещества, получаемые при действии избытка раствора аммиака на растворы AgNO3, Hg(NO3)2, Zn(NO3)2?
Составьте молекулярные и ионные уравнения реакций.
Решение. При действии избытка раствора аммиака на растворы приведенных в условии задачи солей протекают следующие реакции:
AgNO3 + 2NH4OH = [Ag(NH3)2]NO3 + 2H2O,
Hg(NO3)2 + 4NH4OH = [Hg(NH3)4](NO3)2 + 4H2O,
Zn(NO3)2 + 4NH4OH = [Zn(NH3)4](NO3)2 + 4H2O.
Уравнения реакций в сокращенной ионной форме:
Ag+ + 2NH4OH = [Ag(NH3)2]+ + 2H2O,
Hg2+ + 4NH4OH = [Hg(NH3)4]2+ + 4H2O,
Zn2+ + 4NH4OH = [Zn(NH3)4]2+ + 4H2O.
При действии избытка аммиака образуются соединения: [Ag(NH3)2]NO3, [Hg(NH3)4](NO3)2, [Zn(NH3)4](NO3)2, которые относятся к классу комплексных соединений.
Пример 2. Какие степени окисления проявляет марганец в соединениях? Составьте формулы оксидов марганца, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов марганца при переходе от низшей к высшей степени окисления? Составьте уравнения реакций взаимодействия оксида марганца (II) с серной кислотой и оксида марганца (III) с гидроксидом калия.
Решение. В соединениях марганец проявляет пять степеней окисления - (+2, +3, +4, +6, +7), но образует всего четыре простых устойчивых оксида: MnO – оксид марганца(II), Mn2O3 – оксид марганца(III), MnO2 – оксид марганца(IV) и Mn2O7 – оксид марганца(VII). Первые два оксида MnO и Mn2O3 обладают основными свойствами.
Оксид марганца(IV) амфотерен со слабо выраженными кислотными и основными свойствами. Высший оксид марганца Mn2O7 является типичным кислотным оксидом. Триоксид марганца, отвечающий степени окисления (+6), не получен.
Напишем уравнения реакций, необходимых по условию задачи:
MnO + H2SO4 = MnSO4 + H2O.
Mn2O7 + 2KOH = 2KMnO4 + H2O.
Пример 3. Составьте электронные и молекулярные уравнения реакций растворения золота в царской водке и взаимодействия вольфрама с хлором. Золото окисляется до степени окисления (+3), а вольфрам - до максимальной.
Решение. Царская водка – это смесь одного объема азотной и трех – четырех объемов концентрированной соляной кислоты. При смешивании кислот образуется хлор в момент выделения, который и окисляет золото:
2HNO3 + 6HCl = 3Cl2 + 4H2O + 2NO.
Электронные уравнения:
2 | Au0 – 3  = Au3+,
= Au3+,
3 | Cl 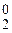 +2
+2  =2Cl–.
=2Cl–.
Молекулярное уравнение реакции:
2Au + 2HNO3 + 8HCl = 2H[AuCl4] + 4H2O + 2NO.
Максимальная степень окисления вольфрама, как элемента шестой группы, равна (+6). Хлор в данной задаче выступает в роли окислителя и, присоединив электроны, приобретает степень окисления (–1). На основе вышеизложенного составим электронные уравнения:
| W – 6  =
=  ,
,
3 | Cl2 +2  =2Cl–1.
=2Cl–1.
Уравнение реакции имеет вид
W + 3Cl2 = WCl6.
Пример 4. Через подкисленный серной кислотой раствор дихромата калия пропустили газообразный сероводород. Через некоторое время оранжевая окраска перешла в зеленую и одновременно жидкость стала мутной. Составьте молекулярное и электронное уравнения происходящей реакции, учитывая минимальное окисление сероводорода.
Решение. Оранжевая окраска исходного раствора обусловлена ионами Cr2O 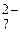 . Зеленый цвет после пропускания сероводорода сообщают ионы Cr3+.
. Зеленый цвет после пропускания сероводорода сообщают ионы Cr3+.
Следовательно, хром (+6) восстанавливается до хрома (+3). В сероводороде степень окисления серы равна (–2). Минимальное окисление сероводорода означает, что сера (–2) отдает минимальное число электронов и приобретает степень окисления, равную нулю. Составим электронные уравнения:
2 |  + 3
+ 3  =
=  ,
,
3 | S2– – 2  =S0.
=S0.
На основании электронных уравнений составим молекулярное уравнение реакции:
K2Cr2O7 + 4H2SO4 + 3H2S = 3S¯ + Cr2(SO4)3 + K2SO4 + 7H2O.
Пример 5. На гидроксиды хрома (III) и никеля (II) подействовали избытком раствора серной кислоты, едкого натрия и аммиака. Какие соединения хрома и никеля образуются в каждом из этих случаев? Составьте молекулярные и ионные уравнения реакций.
Решение. Гидроксид хрома(III) Cr(OH)3 является амфотерным основанием. Поэтому он взаимодействует и с кислотами, и с гидроксидами:
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O,
2Cr(OH)3 + 6H+ = 2Cr3+ + 6H2O.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6],
Cr(OH)3 + 3OH– = [Cr(OH)6]3–.
Cr(OH)3 + 6NH4OH = [Cr(NH3)6](OH)3 + 6H2O,
Cr(OH)3 + 6NH4OH = [Cr(NH3)6]3+ + 3OH– + 6H2O.
Гидроксид никеля(II) обладает только основными свойствами и с едким натрием не взаимодействует. В серной кислоте и аммиаке он растворяется с образованием комплексных соединений:
Ni(OH)2 + H2SO4 + 4H2O = [Ni(H2O)6]SO4,
Ni(OH)2 + 2H+ + 4H2O = [Ni(H2O)6]2+.
Ni(OH)2 + 6NH4OH = [Ni(NH3)6](OH)2 + 6H2O,
Ni(OH)2 + 6NH4OH = [Ni(NH3)6]2+ + 6H2O + 2OH–.
Пример 6. Как получить берлинскую лазурь, имея в качестве исходных веществ железный купорос, азотную кислоту и цианистый калий? Напишите молекулярное и ионные уравнения реакций, приводящих к образованию берлинской лазури из указанных веществ.
Решение. В состав берлинской лазури Fe4[Fe(CN)6]3 входит железо в степени окисления (+2) и (+3).
Последовательность операций.
Делим железный купорос FeSO4 на две части, к первой прибавляем избыток раствора цианистого калия:
FeSO4 + 6KCN = K4[Fe(CN)6] + K2SO4,
Fe2+ + 6CN– = [Fe(CN)6]4–.
Ко второй части приливаем раствор азотной кислоты для окисления железа от (+2) до (+3):
3FeSO4 + 4HNO3 = 3FeNO3SO4 + NO + 2H2O,
3Fe2+ + 4NO3– = 3Fe3+ + NO + 2H2O.
Слив оба раствора, получим нерастворимый в воде осадок берлинской лазури:
4FeNO3SO4 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 4KNO3 + 4K2SO4,
4Fe3+ + 3[Fe(CN)6]4– = Fe4[Fe(CN)6]3.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 558; Нарушение авторских прав?; Мы поможем в написании вашей работы!