
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Часть 2. Аналитическая химия
|
|
|
|
Для ответов на вопросы по аналитической химии нужно пользоваться учебником: И. К. Цитович. Курс аналитической химии. –СПб.: Издательство «Лань», 2004. –496 с.
281. Что такое качественная реакция? Опишите главные особенности качественных реакций (специфичность, интенсивность, чувствительность).
Что такое частная реакция? Перечислите частные реакции на ион Fe2+.
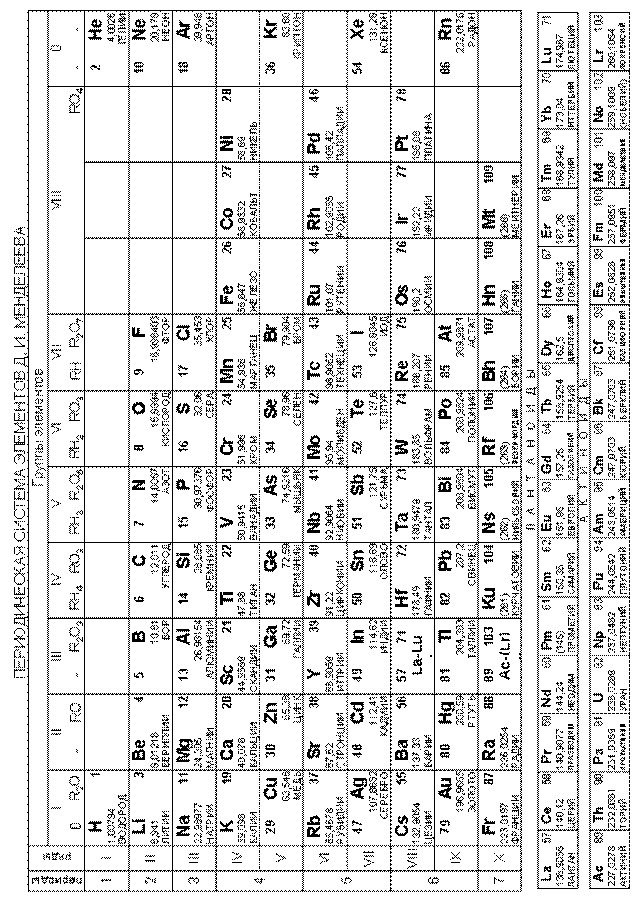
282. Какие катионы относятся к I аналитической группе? Охарактеризуйте свойства этих катионов (растворимость их оснований и солей). Укажите положение металлов, образующих катионы I группы в периодической системе. Напишите уравнения основных частных реакций иона Na+.
283. Какие катионы относятся ко II аналитической группе? Укажите положение металлов, образующих эти катионы, в периодической системе. Напишите уравнения основных частных реакций ионов Ва2+.
284. Перечислите катионы, относящиеся к III аналитической группе. Охарактеризуйте свойства этих катионов (растворимость их оснований и солей). Напишите реакцию взаимодействия иона А13+ с групповым реактивом этой группы.
285. Опишите, как проводится систематический анализ катионов. Напишите уравнения реакций, соответствующих предварительным испытаниям.
286. Перечислите катионы, относящиеся к IV аналитической группе, охарактеризуйте свойства этих катионов. Напишите частные реакции иона Си2+.
287. Что такое групповой реактив? Перечислите групповые реактивы на катионы II, III, IV аналитических групп. Напишите реакции взаимодействия группового реактива соответствующей труппы с ионами Ва2+, Fe2+, Pb2+.
288. Какие анионы относятся к I аналитической группе? Охарактеризуйте их свойства. Напишите реакции открытия иона SO 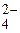 .
.
289. Какие анионы относятся ко II аналитической группе? Охарактеризуйте их свойства. Напишите реакции открытия ионов
Вr–.
290. Какие анионы относятся к III аналитической группе? Охарактеризуйте их свойства. Напишите реакцию взаимодействия иона NO 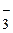 с FeSO4.
с FeSO4.
291. Опишите основные методы объемного анализа. Рассчитайте, сколько концентрированной хлороводородной кислоты плотностью 1,19 надо взять для приготовления 1 литра 0,1 н. раствора.
292. Какие индикаторы применяются при определениях методом нейтрализации? Что такое область пepexодa индикатора? Какую окраску имеет метилоранж при рН < 3,1? При рН > 4,4? Рассчитайте, сколько граммов гидроксида натрия содержится в 1 мл 0,5 н. его раствора?
293. Какие растворы называются приготовленными? Что такое титрование, эквивалентная точка титрования? Что называется титром? Титр раствора Na2CО3 равен 0,00530 г/мл. Сколько граммов Na2CO3 содержится в 250 мл этого раствора?
294. Что лежит в основе определений методом редоксиметрии? Как подразделяются эти методы? Какие рабочие растворы применяются при титровании методом перманганатометрии, иодометрии? Составьте уравнение реакции взаимодействия КМО4 с FeSО4 в сернокислом растворе и рассчитайте, сколько граммов КМпО4 потребуется для окисления 20 г FeSО4 в данных условиях.
295. Что называется эквивалентом? Как рассчитывается эквивалент кислот и оснований при реакции нейтрализации, при окислительно-восстановительной реакции? Определите нормальность раствора йода и его титр, если на титрование 23 мл иода пошло 10,67 мл 0,056 н. раствора тиосульфата натрия.
296. Напишите уравнения реакций между перманганатом калия и сульфитом калия в кислой, щелочной и нейтральной средах, и рассчитайте эквивалент окислителя и восстановителя.
297. Как проводятся количественные определения хромато-метрическим методом? Закончите уравнения реакции и рассчитайте эквивалент К2Сr2О7 в этих реакциях.
а) К2Сr2O7 + КОН ®,
б) К2Сr2O7 + СаСl2 + H2О ®,
в) К2Сr2O7 + H2SO4 + NaNO2 ®.
298. Укажите, какие индикаторы и почему можно применить при титровании:
а) сильной кислоты сильным основанием,
б) сильной кислоты слабым основанием,
в) слабой кислоты слабым основанием;
г) слабой кислоты сильным основанием.
Рассчитайте, чему равны титры:
а) 1 н. раствора НС1, б) 0,1 н. раствора NH4OH, в) 0,01 н. раствора Н3РО4.
299. Опишите ход определения жесткости воды комплексонометрическим методом. Чему равна жесткость воды, если на титрование 100 мл воды потребовалось 5 мл 0,1 н. трилона Б?
300. Что лежит в основе хроматографического метода анализа? Где он применяется?
ПРИЛОЖЕНИЕ
Стандартные теплоты (энтальпии) образования
DН0 298 некоторых веществ
| Вещество | Состоя-ние | DН0 298, кДж/моль | Вещество | Состоя-ние | DН0 298, кДж/моль |
| CS2 NO C6H8 C2H4 H2S NH3 CH4 C2H6 HCl CO | Г Г Г Г Г Г Г Г Г Г | 115,28 +90,37 +82,93 +52,28 –20,15 –46,19 –74,85 –84,67 –92,31 –110,52 | CH3OH C2H5OH H2O H2O NH4Cl CO2 Fe2O3 Ca(OH)2 Al2O3 | Г Г Г Ж К Г К К К | –201,17 –235,31 –241,83 –285,84 –315,39 –393,51 –822,10 –986,50 –1669,8 |
Стандартные абсолютные энтропии S0 298
некоторых веществ
| Вещество | Состоя-ние | S0 298, Дж/(моль × К) | Вещество | Состоя-ние | S0 298, Дж/(моль × К) |
| С C S FeO H2O NH4Cl CH3OH H2 Fe3O4 CH4 HCl H2O N2 | Алмаз Графит Ромб. К Ж К Ж Г К Г Г Г Г | 2,44 5,69 31,9 54,0 69,94 94,50 126,8 130,59 146,40 186,19 186,68 188,72 191,49 | NH3 CO C2H2 O2 H2S NO CO2 C2H4 Cl2 NO2 PCl3 PCl5 | Г Г Г Г Г Г Г Г Г Г Г Г | 192,50 197,91 200,82 205,03 205,64 210,20 213,65 219,45 222,95 240,16 311,66 352,71 |
Стандартная энергия Гиббса образования
DG0 298 некоторых веществ
| Вещество | Состоя-ние | DG0 298, кДж/моль | Вещество | Состоя-ние | DG0 298, кДж/моль |
| BaCO3 CaCO3 Fe3O4 BeCO3 CaO BeO BaO CO2 | К К К К К К К Г | –1138,80 –1228,75 –1014,20 –944,75 –604,20 –581,61 –528,40 –394,38 | FeO H2O H2O CO CH4 NO2 NO C2H2 | К Ж Г Г Г Г Г Г | –244,30 –237,19 –228,59 –137,27 –50,79 +51,84 +86,69 +209,20 |
Константы диссоциации слабых электролитов
| Название электролита | Химическая формула | Константа диссоциации |
| Азотистая кислота | HNO2 | К = 4,0 × 10–4 |
| Пероксид водорода | H2O2 | K1 = 2,6×10–12; К2 = 2,0×10–25 |
| Кремниевая кислота | H2SiO3 | К1 = 2,2×10–10; К2 = 1,0×10–12 |
| Сернистая кислота | H2SO3 | К1 = 1,6×10–2; К2 = 6,3×10–2 |
| Сероводород | H2S | К1 = 6,0×10–2; К2 = 1,0×10–14 |
| Ортофосфорная кислота | H3PO4 | К1 = 7,5×10–3; К2 = 6,3×10–8; К3 = 1,3×10–12 |
| Угольная кислота | H2CO3 | К1 = 4,5×10–7; К2 = 4,7×10–11 |
| Уксусная кислота | CH3COOH | К = 1,8×10–5 |
| Фтороводород | HF | К = 6,6×10–4 |
| Циановодород (синильная кислота) | HCN | К = 7,8×10–10 |
| Гидроксид аммония | NH4OH | К = 1,8×10–5 |
Растворимость солей и оснований в воде
| Кати-оны | Анионы | |||||||||||
| Cl– | Br– | J– | NO3– | CH3COO– | S2– | SO32– | SO42– | CO32– | SiO32– | PO43– | OH– | |
| Li+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Н | Р |
| Na+, | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р |
| Cu2+ | Р | Р | – | Р | Р | Н | Н | Р | – | – | Н | Н |
| Ag+ | Н | Н | Н | Р | Р | Н | Н | М | Н | – | Н | – |
| Mg2+ | Р | Р | Р | Р | Р | – | Н | Р | Н | Н | Н | Н |
| Са2+ | Р | Р | Р | Р | Р | Р | Н | М | Н | Н | Н | М |
| Sr+ | Р | Р | Р | Р | Р | Р | Н | Н | Н | Н | Н | М |
| Ba2+ | Р | Р | Р | Р | Р | Р | Н | Н | Н | Н | Н | Р |
| Zn2+ | Р | Р | Р | Р | Р | Н | Н | Р | Н | Н | Н | Н |
| Hg2+ | Р | М | Н | Р | Р | Н | – | Р | – | – | Н | – |
| Al3+ | Р | Р | Р | Р | Р | – | – | Р | – | Н | Н | Н |
| Sn2+ | Р | Р | Р | – | – | Н | – | Р | – | – | Н | Н |
| Pb2+ | М | М | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н |
| Bi3+ | – | – | – | Р | – | Н | Н | – | Н | – | Н | Н |
| Cr3+ | Р | Р | Р | Р | – | – | – | Р | – | – | Н | Н |
| Mn2+ | Р | Р | Н | – | Р | Н | Н | Р | Н | Н | Н | Н |
| Fe3+ | Р | Р | – | Р | – | Н | – | Р | – | Н | Н | Н |
| Fe2+ | Р | Р | Р | Р | Р | Н | Н | Р | Н | Н | Н | Н |
(Р – растворимое вещество; М – малорастворимое вещество;
Н – практически нерастворимое вещество; прочерк означает, что вещество не существует или разлагается водой)
Ряд стандартных электродных потенциалов металлов
| Электрод | Электродная реакция | Е0, В |
| Li+/Li | Li+ +  = Li = Li
| –3,045 |
| K+/K | K+ +  = K = K
| –2,925 |
| Rb+/Rb | Rb+ +  =Rb =Rb
| –2,925 |
| Cs+/Cs | Cs+ +  =Cs =Cs
| –2,923 |
| Ba2+/Ba | Ba2+ + 2 =Ba =Ba
| –2,906 |
| Ca2+/Ca | Ca2+ + 2 =Ca =Ca
| –2,866 |
| Na+/Na | Na+ +  =Na =Na
| –2,714 |
| Mg2+/Mg | Mg2+ + 2 =Mg =Mg
| –2,363 |
| Be2+/Be | Be2++ 2 =Be =Be
| –1,847 |
| Al3+/Al | Al3+ + 3 =Al =Al
| –1,662 |
| Mn2+/Mn | Mn2+ + 2 =Mn =Mn
| –1,179 |
| Zn2+/Zn | Zn2+ + 2 =Zn =Zn
| –0,763 |
| Cr3+/Cr | Cr3+ + 3 =Cr =Cr
| –0,744 |
| Fe2+/Fe | Fe2+ + 2 =Fe =Fe
| –0,440 |
| Cd2+/Cd | Cd2+ + 2 =Cd =Cd
| –0,403 |
| Co2+/Co | Co2+ + 2 =Co =Co
| –0,277 |
| Ni2+/Ni | Ni2+ + 2 =Ni =Ni
| –0,250 |
| Sn2+/Sn | Sn2+ + 2 =Sn =Sn
| –0,136 |
| Pb2+/Pb | Pb2+ + 2 =Pb =Pb
| –0,126 |
| 2H+/H2 | 2H+ + 2 =H2 =H2
| 0,000 |
| Cu2+/Cu | Cu2+ + 2 =Cu =Cu
| +0,337 |
| Ag+/Ag | Ag+ +  =Ag =Ag
| +0,799 |
| Hg2+/Hg | Hg2+ + 2 =Hg =Hg
| +0,854 |
| Pd2+/Pd | Pd2+ + 2 =Pd =Pd
| +0,987 |
| Pt2+/Pt | Pt2+ + 2 =Pt =Pt
| +1,190 |
| Au3+/Au | Au3+ + 3 =Au =Au
| +1,498 |
ЛИТЕРАТУРА
1. Глинка Н.Л. Общая химия. М.; ИНТЕГРАЛ-ПРЕСС, 2001. 704 с.
2. Хомченко Г.П., Цитович И.К. Неорганическая химия. Учебник для сельскохозяйственных вузов. М.: Высшая школа, 2002. 320 с.
3. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа, 2002. 743 с.
4. Коровин Н. В. Общая химия. М.: Высшая школа, 2000. 558 с.
5. Пустовалова Л. М., Никанорова И. Е. Общая химия. Ростов-на-Дону.: Феникс. 2005. 478 с.
6. Гельфман М. И., Юстратов В. П. Химия. С-Пб.:Лань. 2000. 480 с.
7. Горбунов А. И., Гуров А. А., Филиппов Г. Г., Шаповал В. Н. Теоретические основы общей химии. М.: Изд-во МГТУ им Н. Э. Баумана. 2003. 720 с.
8. Баличева Т. Г., Белорукова Л. П., Зиньчук Р. А. и др. Физические методы исследования неорганических веществ. М.: Издательский центр Академия. 2006. 448 с.
9. Цитович И. К. Курс аналитической химии. С-Пб.:Лань. 2004. 496 с.
бие для вузов. М.: Высшая школа, 1979.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ.. 3
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ И ЗАДАНИЕ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ... 5
ЧАСТЬ 1. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ.. 7
1.1. Моль. Эквиваленты и молярные массы эквивалентов простых и сложных веществ. Закон эквивалентов. 7
1.2. Строение атома. 12
1.3. Химическая связь и строение молекул. Конденсированное состояние вещества. 20
1.4. Энергетика химических процессов (термохимические расчеты) 24
1.5. Химическая кинетика и равновесие. 35
1.6. Растворы неэлектролитов. 42
1.7. Растворы электролитов. 47
1.8. Окислительно-восстановительные реакции. 54
1.9. Электродные потенциалы. Гальванические элементы.. 64
1.10. Электролиз. 71
1.11. Коррозия металлов. 75
1.12. Общие свойства металлов. 82
1.13. Элементы V группы.. 93
ЧАСТЬ 2. АНАЛИТИЧЕСКАЯ ХИМИЯ.. 96
ПРИЛОЖЕНИЕ.. 99
ЛИТЕРАТУРА.. 104
ОГЛАВЛЕНИЕ.. 104
ОБЩАЯ, НЕОРГАНИЧЕСКАЯ И
АНАЛИТИЧЕСКАЯ ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ
И ЗАДАНИЯ ДЛЯ КОНТРОЛЬНЫХ РАБОТ
Методические указания
Грачева Екатерина Васильевна
Головнева Ирина Ивановна
Демина Ольга Васильевна
Редактор
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1061; Нарушение авторских прав?; Мы поможем в написании вашей работы!