
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементы V группы
|
|
|
|
Пример 1. На основании электронных уравнений составьте уравнение реакции взаимодействия серы с азотной кислотой, учитывая, что сера окисляется максимально, а азот восстанавливается минимально.
Решение. Определим, какие вещества могут образовываться в результате реакции. Сера в своих соединениях проявляет следующие степени окисления: (–2, +2, +4, +6). Максимальная степень окисления (+6), она реализуется в следующих соединениях: серной кислоте, триоксиде серы и сульфатах. В кислой среде образуется серная кислота.
Для азота характерны степени окисления (–3, +1, +2, +3, +4, +5). В азотной кислоте степень окисления равна (+5), а так как азот восстанавливается минимально, то он принимает один электрон и приобретает степень окисления (+4). Устойчивым соединением азота с такой степенью окисления является NO2.
Электронные уравнения:
6 | S0 – 6  =
= 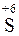 – окисление,
– окисление,
1 | 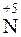 +1
+1  =
= 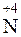 – восстановление.
– восстановление.
Уравнение реакции взаимодействия серы с азотной кислотой
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O.
Пример 2. Напишите формулы и назовите оксиды азота, укажите степени окисления азота в каждом из них. Какой из этих оксидов более сильный окислитель? На основании электронных уравнений закончите уравнение реакции, учитывая, что азот приобретает минимальную степень окисления:
KNO2 + Al + KOH + H2O = KAlO2 + …
Решение. Формула Наименование оксида Степени окисления
N2O оксид азота(I) +1
NO оксид азота(II) +2
N2O3 оксид азота(III) +3
NO2 оксид азота(IV) +4
N2O5 оксид азота(V) +5
Наиболее сильным окислителем является оксид азота (V), так как в этом соединении азот имеет максимальную степень окисления.
Определим, какие вещества образуются в результате реакции, приведенной в условии задачи. Минимальная степень окисления азота равна (–3). Она реализуется в аммиаке и ионе аммония NH4+. Среда щелочная, следовательно, образуется аммиак:
KNO3 + KOH + Al + H2O = KAlO2 + NH3.
Составим электронные уравнения:
8 | Al0 – 3  = Al3+ – окисление,
= Al3+ – окисление,
3 | 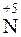 + 8
+ 8  =
= 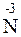 – восстановление.
– восстановление.
С учетом коэффициентов, уравнение реакции будет иметь вид:
8Al + 3KNO3 + 5KOH + 2H2O = 8KAlO2 + 3NH3.
Задания
271. Значение азота и фосфора как биогенных элементов. Чем обусловлен дефицит азота и фосфора в культурных почвах? Рассчитайте процентное содержание Р2О5 в простом суперфосфате.
272. Строение атома азота, особенности его валентных состояний в сравнении с валентностями фосфора и мышьяка. Чем обусловлена прочность молекулы азота и проблема связывания азота?
273. Напишите уравнения реакций и укажите условия получения аммиака в лаборатории и технике. Закончите уравнения реакций: NH3 + H2О®, NH3 + Hl®, NH4NO3  .
.
274. Расскажите, как и для чего получают в промышленности азотную кислоту. Особенности взаимодействия азотной кислоты с металлами. Приведите уравнения реакций, иллюстрирующих эти свойства.
275. Перечислите основные виды азотных удобрений. Рассчитайте процентное содержание азота в удобрениях, содержащих азот в нитратной форме.
276. Перечислите кислородные кислоты фосфора. Дайте их сравнительную характеристику. Закончите уравнения реакций, с помощью которых получают фосфор в промышленности. Ca3(PО4)2 + SiО2  C; Р2О5 + С
C; Р2О5 + С  .
.
277. Какие фосфорные удобрения вам известны? Почему преципитаты и фосфориты рекомендуется применять на кислых почвах? Ответ подтвердите уравнениями реакций.
278. Какие элементы V группы являются микроэлементами? В каких дозах (в сравнении с макроэлементами) вносят в почву микроэлементы? Закончите уравнения реакций:
AsH3  As2О3 + NaOH ®.
As2О3 + NaOH ®.
279. Особенности химии мышьяка. Какие соединения мышьяка применяют в сельском хозяйстве?
280. Опишите химические и физические свойства металлов V группы побочной подгруппы, обусловливающие применение их в технике.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 579; Нарушение авторских прав?; Мы поможем в написании вашей работы!