
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов 3 страница
|
|
|
|
2H2O - 4  = O2 + 4H+.
= O2 + 4H+.
3. При очень высоких потенциалах разложения и из расплавов возможно окисление остатков кислородсодержащих кислот, например,
4NO 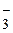 - 4
- 4  =2N2O5 + O2; 2SO
=2N2O5 + O2; 2SO 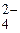 - 2
- 2  = 2SO3 + O2.
= 2SO3 + O2.
Напишем схему электролиза раствора хлорида магния:
MgCl2 D Mg2+ + 2Cl–,
H2O D H+ + OH–.
катод (-); Mg2+; H+; 2H+ + 2  = H2 – восстановление,
= H2 – восстановление,
анод (+); OH–; Cl–; 2Cl– - 2  = 2Cl0 ® Cl
= 2Cl0 ® Cl 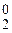 – окисление,
– окисление,
в растворе - Mg2+ + 2OH– = Mg(OH)2.
Пример 2. Составьте электродные уравнения процессов, протекающих на электродах при электролизе раствора сульфата никеля в случае никелевого анода.
Решение. Материалом для анода могут служить как металлы, так и любые токопроводящие материалы, например, графит или уголь.
При электролизе сульфата никеля с никелевым анодом он будет активным (растворимым). Металл анода окисляется, в отличие от угольного электрода, который является инертным и служит только как проводник электронов. Процесс с растворимым анодом нашел широкое применение в технике.
Напишем схему электролиза сульфата никеля с никелевым анодом:
NiSO4 D Ni2+ + SO 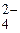
H2O D H+ + OH–
катод (-); Ni2+; H+; Ni2+ + 2  = Ni0;
= Ni0;
анод (+); Ni0; OH–; SO 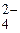 ; Ni0 - 2
; Ni0 - 2  = Ni2+.
= Ni2+.
Пример 3. В одном сосуде имеется раствор, содержащий ионы меди, в другом - раствор, содержащий ионы висмута. Через оба раствора пропущено одинаковое количество электричества. Сколько выделилось висмута, если масса выделившейся меди равна двум граммам?
Решение. По второму закону электролиза Фарадея: “Массы выделившихся на электродах веществ пропорциональны молярным массам эквивалентов ”:
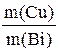 =
= 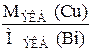 .
.
Молярная масса эквивалента металла равна частному от деления атомной массы металла на его валентность:
МЭКВ.(Cu) = 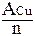 =
= 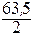 = 31,8 г/моль.
= 31,8 г/моль.
МЭКВ.(Bi) = 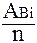 =
= 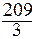 = 69,6 г/моль.
= 69,6 г/моль.
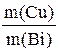 =
= 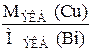 Þ mBi =
Þ mBi = 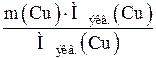 =
= 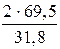 = 4,4 г.
= 4,4 г.
Задания
191. Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ.
192. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов AlCl3, NiSО4. В обоих случаях анод угольный.
193. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода (н.у.). Сколько граммов меди выделилось на катоде?
194. Сколько граммов воды разложилось при электролизе раствора Nа2SO4 при силе тока 7 А в течение 5 ч?
195. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Сколько граммов серебра выделилось на катоде?
196. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла.
197. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора KOH, расплава KOH.
198. Электролиз раствора сульфата цинка проводили в течение
5 ч, в результате чего выделилось 6 л кислорода (н. у.). Вычислите силу тока.
199. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Al2(SО4)3 в случае угольного анода; в случае алюминиевого анода.
200. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaJ в течение 2,5 ч, если сила тока равна 6 А?
201. При электролизе раствора AgNO3 масса серебряного анода уменьшилась на 5,4 г. Сколько кулонов электричества израсходовано на этот процесс?
202. Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора KВr в течение 1 ч 35 мин при силе тока 15 А?
203. Составьте электронные уравнения процессов, происходящих при электролизе CuCl2, если анод медный, если анод угольный?
204. На электролиз раствора CaCl2 израсходовано 10722,2 Кл электричества. Вычислите массу выделяющихся на угольных электродах и образующегося возле катода веществ.
205. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КСl; расплава КСl.
206. Сколько времени проводят электролиз раствора электролита при силе тока 5 А, если на катоде выделяется 0,1 эквивалент вещества? Сколько вещества выделится на аноде?
207. При электролизе растворов MgSO4 и ZnCl2 соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделится на другом катоде; на анодах?
208. Чему равна сила тока, если при электролизе раствора MgCl2 в течение 30 мин на катоде выделилось 8,4 л водорода (н.у.). Вычислите массу вещества, выделяющегося на аноде.
209. Сколько граммов H2SО4 образуется возле анода при электролизе раствора Na2SO4, если на аноде выделяется 1,12 л кислорода, измеренного при н.у.? Вычислите массу вещества, выделяющегося на катоде.
210. Вычислите силу тока, зная, что при электролизе раствора KOH в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г кислорода. Какое вещество и в каком количестве выделяется на катоде?
1.11. Коррозия металлов
Пример 1. Железная пластинка, погруженная в раствор серной кислоты, медленно разрушается, выделяя водород. Если к железной пластинке в растворе прикоснуться платиновой проволокой, то водород начинает выделяться на платине, а железо – разрушаться интенсивнее. Дайте объяснение этому явлению.
Решение. Процесс самопроизвольного разрушения металла, вызываемый химическим или электрохимическим взаимодействием его с окружающей средой, называется коррозией.
При погружении железной пластинки в раствор серной кислоты протекает окислительно-восстановительная реакция:
Fe + H2SO4 = FeSO4 + H2,
Fe0 – 2  = Fe2+ – окисление,
= Fe2+ – окисление,
2H+ + 2  = H2 – восстановление.
= H2 – восстановление.
Если к железной пластинке прикоснуться платиновой проволокой, то в среде электролита возникает в месте контакта металлов гальванический элемент, появляется электродвижущая сила и окислительно-восстановительная реакция ускоряется. Железо в этом элементе – анод, оно окисляется и разрушается; платина – катод, на ней протекает восстановление ионов водорода. Такой вид электрохимической коррозии называется микрогальванокоррозией. Схема коррозии железа в контакте с платиной в среде серной кислоты имеет вид:
Fe ê H2SO4 ê Pt,
анод (Fe) - Fe0 – 2  = Fe2+ – окисление,
= Fe2+ – окисление,
катод (Pt) - 2H+ + 2  = H2 – восстановление,
= H2 – восстановление,
Fe2+ + SO 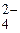 = FeSO4.
= FeSO4.
Пример 2. Как протекает процесс коррозии цинка, покрытого слоем никеля в кислой и нейтральной средах, если целостность слоя нарушена?
Решение. При контакте двух металлов с разными значениями электродных потенциалов в среде электролита образуется микрогальваническая пара и протекает электрохимическая коррозия.
При электрохимической коррозии анодный процесс – это всегда окисление, разрушение металла. Из двух контактирующих металлов разрушается более активный с меньшим значением электродного потенциала по схеме:
Me0 - n  = Men+.
= Men+.
Ионы металла переходят в раствор электролита, а в металле накапливается избыток электронов.
Катодный процесс протекает по-разному, в зависимости от pH среды:
1. В кислой среде обычно восстанавливаются ионы водорода по схеме
2H+ + 2  = H2.
= H2.
2. В нейтральной и щелочной средах восстанавливается кислород по схеме
O2 + 2H2O + 4  = 4OH–.
= 4OH–.
Рассмотрим процесс коррозии цинка, покрытого никелем в кислой среде:
(-) A Zn ê H2SO4 ê Ni K (+).
Анодом в этой паре будет цинк (E0Zn = – 0,74 В, E0Ni = – 0,25 В), он и будет окисляться, разрушаться:
анод (Zn) – Zn0 - 2  = Zn2+.
= Zn2+.
Никель играет роль катода и на нем в кислой среде восстанавливаются ионы водорода:
катод (Ni) – 2H+ + 2  = H2,
= H2,
Zn2+ + SO 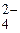 = ZnSO4.
= ZnSO4.
Аналогично протекает процесс коррозии в нейтральной среде. Отличие только в катодном процессе, т. к. в данном случае на катоде восстанавливается кислород:
Zn ê O2, H2O ê Ni,
анод (Zn) – Zn0 - 2  = Zn2+,
= Zn2+,
катод (Ni) – O2 + 2H2O + 4  = 4OH–,
= 4OH–,
Zn2+ + 2OH– = Zn(OH)2.
При микрогальванокоррозии металл катода не подвергается коррозии и не разрушается.
Пример 3. Приведите пример анодной и катодной защиты железа от коррозии (метод металлических покрытий). Как будет протекать коррозия при нарушении целостности покрытия в кислой среде? Какое покрытие – анодное или катодное - более надежно защищает железо?
Решение. Для защиты металлов от коррозии применяют различные виды покрытий, в том числе и металлические. Металлические покрытия могут быть анодными и катодными, в зависимости от того, анодом или катодом будет покрытие металла в микрогальванической паре.
Анодным покрытием на железе будет металл, стоящий в ряду напряжений левее, т. е. с меньшим значением электродного потенциала, например, марганец (E0Mn = – 1,05 В, E0Fe = – 0,44 В).
В технике в качестве анодного покрытия на железе используется цинк (оцинкованное железо). Составим схему коррозии оцинкованного железа в кислой среде:
Zn ê HCl ê Fe,
анод (Zn) – Zn0 - 2  = Zn2+,
= Zn2+,
катод (Fe) – 2H+ + 2  = H2,
= H2,
Zn2+ + 2Cl– = ZnCl2.
Чтобы покрытие было катодным, железо нужно покрыть металлом с большим значением электродного потенциала, например, оловом (железо луженое). Олово в паре с железом играет роль катода. Напишем схему коррозии луженого железа в кислой среде:
Zn ê HCl ê Sn,
анод (Fe) – Fe0 – 2  = Fe2+,
= Fe2+,
катод (Sn) – 2H+ + 2  = H2,
= H2,
Fe2+ + 2Cl– = FeCl2 ® FeCl3.
Как видно из приведенных примеров, если нарушается целостность покрытия анодного типа (оцинкованное железо), корродирует металл покрытия, а основной металл не разрушается. Если же нарушается целостность покрытия катодного типа, корродирует основной металл. Следовательно, анодное покрытие более надежно, чем катодное.
Пример 4. Если на стальную пластинку нанести каплю воды и оставить на некоторое время, то после высыхания воды в центре появится пятно ржавчины. Чем можно объяснить это явление?
Решение. Различные концентрации электролита могут вызывать коррозию, создавая гальваническую пару даже с одинаковыми металлами (уравнения Нернста, см. пример 2.4). Различное содержание кислорода в электролите также приводит к образованию гальванической пары – менее окисленный и более окисленный металл. Поверхностные слои воды в капле содержат больше кислорода, чем внутренние, и поэтому смоченный металл в средней части оказывается более активным (анод), чем во внешней (катод). После высыхания капли в ее центре появляется довольно большое пятно ржавчины, так как всегда разрушается при коррозии металл анода. Если взять достаточно тонкую пластинку стали, то можно получить сквозное отверстие. Напишем схему коррозии железа под каплей воды:
(–)Fe | H2O, O2 | Fe(+),
анод (Fe) – Fe0 – 2  = Fe2+,
= Fe2+,
катод (Fe) – 2H2O + O2 + 4  = 4OH–,
= 4OH–,
Fe2+ + 2OH– = Fe(OH)2 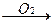 Fe(OH)3.
Fe(OH)3.
Задания
211. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
212. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
213. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
214. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой из последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
215. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты никеля в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
216. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой катодным. Составьте электронные уравнения соответствующих процессов.
217. Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов.
218. В раствор соляной кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
219. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильнокислой среде.
220. Какое покрытие металла называется анодным и какое катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильнокислой среде.
221. Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
222. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
223. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
224. В обычных условиях во влажном воздухе оцинкованное железо при нарушении покрытия не ржавеет, тогда как при температуре выше 70 °С оно покрывается ржавчиной. Чем это можно объяснить? Составьте электронные уравнения анодного и катодного процессов коррозии оцинкованного железа в первом и во втором случаях.
225. Если пластинку из чистого железа опустить в разбавленную серную кислоту, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
226. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
227. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
228. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
229. Магниевую и никелевую пластинки опустили в раствор нитрата меди. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
230. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1849; Нарушение авторских прав?; Мы поможем в написании вашей работы!