
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 7
|
|
|
|
Составьте мо екулярные и ионные уравнения реакций, которые необходимо провести для осуществления следующих превращений:
Co(OH)2 ® Co(OH)3 ® CoCl2 ® CoOHCl.
Решение. Окисление гидроксида кобальта(II) гипохлоритом натрия:
2Co(OH)2 + NaClO + H2O = Co(OH)3 + NaCl,
2Co(OH)2 + ClO– + H2O = Co(OH)3 + Cl–.
При действии кислот на Co(OH)3 получаются соли кобальта(II), а не кобальта(III):
2Co(OH)3 + 6HCl = 2CoCl2 + Cl2 + 6H2O,
2Co(OH)3 +6H+ + 2Cl– = 2Co2+ + Cl2 + 6H2O.
При действии щелочи на раствор соли кобальта(II) при комнатной температуре выпадает осадок основной соли:
CoCl2 + NaOH = CoOHCl¯ +NaCl,
Co2+ + Cl– + OH– = CoOHCl.
Пример 8. Могут ли в растворе существовать совместно следующие вещества: FeCl2 и KMnO4; NiCl2 и NaOH; FeCl2 и K4[Fe(CN)6]? Составьте уравнения реакций.
Решение. Указанные пары могут существовать совместно, если между ними не будут протекать окислительно-восстановительные реакции или реакции обмена.
Степень окисления железа в FeCl2, равная (+2), – промежуточная, а марганца в KMnO4, равная (+7), – высшая. Следовательно, эти вещества будут взаимодействовать, причем KMnO4 – окислитель, а FeCl2 – восстановитель.
Напишем реакции:
3FeCl2 + KMnO4 + 2H2O = 3FeOHCl2 + MnO2 +KOH,
3Fe2+ + MnO 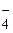 + 2H2O = 3Fe3+ + MnO2.
+ 2H2O = 3Fe3+ + MnO2.
Раствор хлорида никеля содержит только ионы Ni2+ и Cl–. Гидроксид натрия также полностью диссоциирует в растворе на ионы Na+ и OH–. При смешивании растворов NiCl2 и NaOH ионы Ni2+ и OH– связываются друг с другом и образуют нерастворимый в воде гидроксид никеля (II):
NiCl2 + 2NaOH = Ni(OH)2 + 2NaCl,
Ni2+ + 2OH– = Ni(OH)2¯.
В водном растворе FeCl2 и K4[Fe(CN)6] диссоциируют по уравнениям:
FeCl2 D Fe2+ + 2Cl–,
K4[Fe(CN)6] ® 4K+ + [Fe(CN)6]4–.
При смешивании растворов никакие комбинации ионов Fe2+, K+, Cl–, [Fe(CN)6]4– не приводят к образованию малорастворимого, летучего или слабо-диссоциирующего вещества. Следовательно, никакой реакции не происходит.
Итак, в растворе могут существовать совместно только FeCl2 и K4[Fe(CN)6].
Пример 9. Металлическая ртуть часто содержит примеси так называемых “неблагородных” металлов – цинка, олова, свинца. Для их удаления ртуть взбалтывают в насыщенном растворе сульфата ртути. На чем основан такой способ очистки ртути? Выразите происходящие реакции уравнениями.
Решение. Цинк, олово и свинец стоят в ряду напряжений левее ртути. Поэтому они вытесняют ртуть из растворов ее солей. Составим молекулярные и ионные уравнения протекающих реакций:
Zn + HgSO4 = ZnSO4 + Hg,
Zn + Hg2+ = Zn2+ + Hg.
Sn + HgSO4 = SnSO4 + Hg,
Sn + Hg2+ = Sn2+ + Hg.
Pb + HgSO4 = PbSO4 + Hg,
Pb + Hg2+ = Pb2+ + Hg.
Задания
231. Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярное уравнения соответствующей реакции.
232. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Сu ® Cu(NO3)2 ® Сu(ОН)2 ® CuCl2 ® [Cu(NH3)4]CI2.
233. Составьте электронные и молекулярные уравнения реакций цинка: а) с раствором гидроксида натрия; б) с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
234. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Ag ® AgNO3 ® AgCl ® [Ag(NH3)2]CI ® AgCl:
235. При постепенном прибавлении раствора KJ к раствору AgNO3 образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
236. При постепенном прибавлении раствора аммиака к раствору сульфата кадмия образующийся вначале осадок основной соли растворяется. Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
237. При сливании растворов нитрата серебра и цианида калия выпадает осадок, который легко растворяется в избытке KCN. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
238. К какому классу соединений относятся вещества, полученные при действии избытка гидроксида натрия на растворы ZnCl2, CdCl2, HgCl2? Составьте молекулярные и электронные уравнения соответствующих реакций.
239. При действии на титан концентрированной хлороводородной (соляной) кислотой образуется трихлорид титана, а при действии азотной – осадок метатитановой кислоты. Составьте электронные и молекулярные уравнения соответствующих реакций.
240. При растворении титана в концентрированной серной кислоте последняя восстанавливается минимально, а титан переходит в катион с максимальной степенью окисления. Составьте электронные и молекулярное уравнения реакции.
241. Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Иодид калия восстанавливает ионы меди (+2) в соединения меди со степенью окисления (+1). Составьте электронные и молекулярное уравнения взаимодействия KJ с сульфатом меди.
242. Диоксиды титана и циркония при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между; а) ТiO2 и ВаО; б) ZrO2 и NaOH. В первой реакции образуется метатитанат, а во второй – ортоцирконат соответствующих металлов.
243. На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, гидроксида натрия и аммиака. Какие соединения цинка и кадмия образуются в каждой из этих реакций? Составьте молекулярные и ионно-молекулярные уравнения реакций.
244. Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом максимальную степень окисления. Составьте электронные и молекулярные уравнения соответствующих реакций.
245. В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакции. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
246. Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой – избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Составьте уравнения соответствующих реакций.
247. Ванадий получают алюмотермически или кальций термически восстановлением оксида ванадия(V) V2О5 Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на оснований электронных уравнений,
248. Азотная кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярное уравнения реакции.
249. Какую степень окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления. Составьте уравнения реакций: a) V2O3 с H2SО4; б) V2O5 с NaOH.
250. При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4VОз желтая окраска постепенно переходят в фиолетовую за счет образования сульфата ванадия (+2). Составьте электронные и молекулярное уравнения реакции.
251. Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярное уравнения реакции. Какие ионы обусловливают начальную и конечную окраску раствора?
252. Составьте электронные и молекулярные уравнения реакций: а) растворения молибдена в азотной кислоте; б) растворения вольфрама в щелочи в присутствии кислорода. Учтите, что молибден и вольфрам приобретают высшую степень окисления.
253. При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (+3) и железо (+2) окисляются и приобретают соответственно степени окисления (+6) и (+3). Составьте электронные и молекулярное уравнения реакции.
254. К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора перешла в зеленую. Составьте электронные и молекулярное уравнения реакции.
255. Хром получают методом алюмотермии из его оксида(III), а вольфрам восстановлением оксида вольфрама(VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
256. Составьте уравнения реакций, которые надо провести для осуществления превращений: Na2Cr2O7 ® Na2CrO4 ® Na2Cr2O7 ® СгС1з. Уравнение окислительно-восстановительной реакции напишите на основании электронных уравнений.
257. Марганец азотной кислотой окисляется минимально, а рений максимально. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
258. Хлор окисляет манганат калия K2MnO4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения.
259. Как меняется степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакции между КМnО4 и KNO2 в нейтральной среде.
260. На основании электронных уравнений составьте уравнение реакции получения манганата калия K2MnO4 сплавлением оксида марганца(IV) с хлоратом калия КСlO3 в присутствии гидроксида калия. Хлорат восстанавливается максимально.
261. Почему оксид марганца (IV) может проявлять и окислительные, и восстановительные свойства? Исходя из электронных уравнений, составьте уравнения реакций: a) MnO2 + KJ + H2SO4=; б) MnO2 + KNO3 + KOH =
262. Для получения хлора в лаборатории смешивают оксид марганца(IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
263. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Fe ® FeSO4 ® Fe(OH)2 ® Fe(OH)3. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
264. Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fe2+ и Fe3+ в растворе? Составьте молекулярные и ионно-молекулярные уравнения реакций.
265. Чем отличается взаимодействие гидроксидов кобальта(III) и никеля(III) с кислотами от взаимодействия гидроксида железа(III) с кислотами? Составьте электронные и молекулярные уравнения соответствующих реакций.
266. Могут ли в растворе существовать совместно следующие вещества:
a) FeCl3 и SnCl2; б) FeSO4 и NaOH; б) FeCI3 и K3|Fe(CN)6]? Для взаимодействующих веществ составьте уравнения реакций.
267. Составьте уравнения реакций, которые надо провести для осуществления превращений Ni ® Ni(NO3)2 ® Ni(OH)2 ® Ni(OH)3. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
268. Составьте электронные и молекулярные уравнения реакции: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления (+4), а осмий – до (+8).
269. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые надо провести для осуществления следующих превращений: Fe ® FeCl2 ® Fe(CN)2 ® K4[Fe(CN6].
270. Феррат калия K2FeO4 образуется при сплавлении Fe2O3 с калийной селитрой KNO3 в присутствии KOH. Составьте электронные и молекулярное уравнение реакции.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 996; Нарушение авторских прав?; Мы поможем в написании вашей работы!