
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов 1 страница
|
|
|
|
Пример 1. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами:
1. AgNO3 + FeCl3 ®
2. Na2S + HCl ®
3. HCN + KOH ®
4. Zn(OH)2 + NaOH ®
Решение. Реакции в растворах электролитов протекают между ионами, их записывают с помощью ионных уравнений. Большинство этих реакций относят к типу обменных, и сущность их сводится к соединению ионов в молекулы новых веществ. Обязательным условием протекания реакций обмена между электролитами в растворах является присутствие малорастворимых веществ, слабых электролитов, газообразных веществ, комплексных ионов.
При составлении ионного уравнения все перечисленные выше вещества пишутся в виде молекул, а сильные электролиты - в виде ионов, независимо от того, в левой или правой частях уравнения они находятся.
Распишем реакции, приведенные в условии задачи в молекулярном и ионном виде.
Молекулярное уравнение:
3AgNO3 + FeCl3 = 3AgCl¯ + Fe(NO3)3.
Полное ионное уравнение:
3Ag+ + 3NO 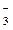 + Fe3+ + 3Cl- = 3AgCl¯ + 3Fe3+ + 3NO
+ Fe3+ + 3Cl- = 3AgCl¯ + 3Fe3+ + 3NO 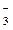 .
.
Если из правой и левой частей уравнения исключить одинаковые ионы, то получим краткое ионное уравнение, выражающее суть данной реакции.
Краткое ионное уравнение:
3Ag+ + 3Cl- = 3AgCl¯.
Подобным образом расписываем остальные реакции.
2. Na2S + 2HCl =2NaCl + H2S.
2Na+ + S2– + 2H+ + 2Cl– =2Na+ + 2Cl– + H2S.
2H+ + S2– = H2S.
3. HCN + KOH = KCN + H2O.
HCN + K+ + OH- = K+ + CN- + H2O.
HCN + OH- = CN- + H2O.
4. Zn(OH)2¯ + 2NaOH = Na2[Zn(OH)4].
Zn(OH)2¯ + 2Na+ + 2OH- = 2Na+ + [Zn(OH)4]2-.
Zn(OH)2¯ + 2OH- = [Zn(OH)4]2-.
Пример 2. К растворам NaCl, HNO3, CuSO4, KNO3 прибавили раствор гидроксида натрия. В каком случае произошла реакция? Напишите молекулярные и ионные уравнения этих реакций.
Решение. Чтобы определить, произошла или нет реакция, распишем молекулярные и ионные уравнения:
1. NaCl + NaOH = NaOH + NaCl,
Na+ + Cl- + Na+ + OH- = Na+ + OH- + Na+ + Cl-.
В левой и правой частях уравнения одни и те же ионы, нет никакого изменения, реакция не идет.
2. HNO3 + NaOH = NaNO3 + H2O,
H+ + NO 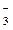 + Na+ + OH- = Na+ + NO
+ Na+ + OH- = Na+ + NO 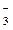 + H2O,
+ H2O,
H+ + OH- = H2O.
Реакция протекает с образованием слабого электролита - воды.
3. CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4,
Cu2+ + SO 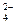 + 2Na+ + 2OH- = Cu(OH)2¯ + 2Na+ + SO
+ 2Na+ + 2OH- = Cu(OH)2¯ + 2Na+ + SO 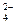 .
.
Cu2+ + 2OH– = Cu(OH)2
Реакция протекает с образованием осадка гидроксида меди.
4. KNO3 +NaOH = KOH + NaNO3,
K+ + NO 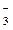 + Na+ + OH- = K+ + OH- + Na+ + NO
+ Na+ + OH- = K+ + OH- + Na+ + NO 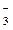 .
.
Реакция не идет, левая и правая части уравнения идентичны.
Пример 3. Какое значение pH (больше или меньше 7) имеют растворы следующих солей: Na2SO4, Na2S, NaCl, CuSO4? Ответ мотивируйте, составив молекулярные и ионные уравнения гидролиза соответствующих солей.
Решение. Гидролиз солей - это реакция обменного разложения между водой и ионами соли, ведущая к образованию слабого электролита, нарушающая диссоциацию воды и, как правило, изменяющая pH раствора. Поэтому гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой, так как они не могут дать слабых электролитов.
Если гидролизу подвергаются многозарядные ионы, гидролиз всегда протекает ступенчато с преобладанием первой стадии и образованием основных и кислых солей. Гидролиз можно усилить, если раствор подогреть или сильно разбавить.
Из солей, приведенных в условии задачи, NaCl и Na2SO4 образованы сильными основаниями и сильными кислотами, поэтому они гидролизу не подвергаются, pH растворов этих солей будет примерно равен 7.
Соль Na2S образована сильным основанием NaOH и слабой кислотой H2S. Гидролиз пойдет по слабому звену - аниону ступенчато:
Na2S D 2Na+ + S2-,
S2- + HOH D HS- + OH-,
Na2S + H2O D NaHS + NaOH.
Выше записано краткое ионное уравнение гидролиза. Чтобы написать на его основе молекулярное уравнение, необходимо к ионам краткого ионного уравнения дописать до компенсации зарядов противоионы от исходной соли, в данном случае ионы Na+.
Соль CuSO4 образована слабым основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз пойдет по слабому звену - катиону Cu2+:
CuSO4 D Cu2+ + SO 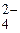 .
.
Краткое ионное уравнение гидролиза:
Cu2+ + HOH D (CuOH)+ + H+.
Молекулярное уравнение гидролиза:
2CuSO4 + 2H2O D (CuOH)2SO4 + H2SO4.
Пример 4. Составьте молекулярные и ионные уравнения гидролиза, происходящего при сливании растворов Cr2(SO4)3 и H2S, зная, что образующийся сульфид хрома не существует в водной среде и полностью гидролизуется.
Решение. При сливании растворов солей происходит следующая обменная реакция:
Cr2(SO4)3 + 3K2S D Cr2S3 + 3K2SO4.
Соль K2SO4 образована сильным основанием KOH и сильной кислотой H2SO4 и гидролизу не подвергается. Соль Cr2S3 образована слабым основанием Cr(OH)3 и слабой кислотой H2S, поэтому гидролиз пойдет по катиону и по аниону до конца.
Краткое ионное уравнение гидролиза соли Cr2S3:
2Cr3+ + 3S2- + 6HOH D 2Cr(OH)3¯ + 3H2S.
Молекулярное уравнение реакции с учетом гидролиза соли:
Cr2(SO4)3 + 3K2S + 6H2O D 3K2SO4 + 2Cr(OH)3¯ + 3H2S.
Задания
121. Электролитическая диссоциация есть процесс распада электролита на ионы под действием:
1) электрического тока, 2) энергии ионов, 3) энергии молекул вещества, 4) полярных молекул растворителя.
122. Степень диссоциации есть отношение:
1) произведения концентраций.ионов, образовавшихся при диссоциации, к концентрации непродиссоциировавших молекул, 2) числа распавшихся на ионы молекул к общему числу растворенных молекул, 3) концентрации ионов к общей концентрации растворенных молекул, 4) концентрации продиссоциированных молекул к концентрация непредиссоциировавших молекул.
123. Константа диссоциации слабых электролитов характеризует их способность диссоциировать на ионы и не зависит от:
1) температуры, 2) концентрации, 3) природы растворителя, 4) природы растворенного вещества.
124. Укажите самое правильное определение понятия «электролиты».
1) вещества, водные растворы которых проводят электрический ток, 2) вещества, проводящие электрический ток,.3) вещества, растворы и расплавы которых проводят электрический ток, 4) вещества, разлагающиеся под действием электрического тока.
125. Укажите среди перечисленных H2S, HF, НCl, НВr, HJ наиболее сильную с точки зрения электролитической диссоциации кислоту:
1) H2S, 2)HF, 3) НС1, 4) НВr, 5) HJ.
126. Укажите среди перечисленных НСlO2, НСlO3, НВrО2,НВrО3 наиболее сильную с точки зрения электролитической диссоциации кислоту:
1) НСlO2, 2) НСlO3, 3) НВrO2, 4) НВrO3.
127. Укажите среди перечисленных Fe(OH)2, Fe(OH)3).
Ni(OH)3, Ni(OH)2 наиболее сильное с точки зрения электролитической диссоциации основание:
1) Fe(OH)2, 2) Fe(OH)3, 3) Ni(OH)3, 4) Ni(OH)2.
128. Для каких из приведенных электролитов можно составить выражение для константы диссоциации?
а) КОН, б) H2SO4, в) HCN, г) KNO3, д) NH4OH.
1) а, в, 2) б, д, 3) в, д, 4) б, г.
129. Какие из перечисленных ионов ОН–, Ве2+, ВеОН+, Н+ могут образоваться при диссоциации гидроксида бериллия:
1) ОН–, Ве2+, ВеОН+, 2) все перечисленные, 3) ОН–, ВеОН+, Н+, 4) ОН–, ВеОН+.
130. Какие из перечисленных Fe3+, SO 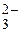 , FeOH2+, (FeOH)
, FeOH2+, (FeOH) 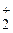 , ОН– ионов преобладают при диссоциации гидроксосульфита железа(II) (FeOH)2SО3?
, ОН– ионов преобладают при диссоциации гидроксосульфита железа(II) (FeOH)2SО3?
1) Fe2+, SO 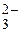 , 2) FeOH2+, ОН–, 3) SO
, 2) FeOH2+, ОН–, 3) SO 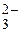 , FeOH+, 4) Fe(OH)
, FeOH+, 4) Fe(OH) 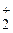 , SO
, SO 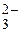 , 5) Fe2+, OH–, SO
, 5) Fe2+, OH–, SO 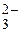 .
.
131. Чему равно ионное произведение воды при 25 °С?
1) 7, 2) 14, 3) 10–14, 4) 10–18.
132. Во сколько раз надо изменить концентрацию, ионов водорода в растворе, чтобы рН его увеличился на единицу?
1) 1, 2) 10, 3) 10–1, 4) 7.
133. Концентрация ионов водорода в растворе равна 2,5 × 10–8 моль/литр. Вычислить концентрацию гидроксид-ионов.
1) 4 × 10–7, 2) 4 × 10–5, 3) 0,4 × 10–7, 4) 0,4 × 10–5.
134. Рассчитайте' концентрацию гидроксид-ионов в растворе, рН которого равен 3.
1) 10–3 моль/л, 2) 10–11 моль/л, 3) 3 моль/л, 4) 11 моль/л.
135. Рассчитайте концентрацию водородных ионов в растворе, если рОН = 11.
1) 11 моль/л, 2) 10–11 моль/л, 3) 10–3 моль/л, 4) 3 моль/л.
136. рН раствора равен 11. Вычислить концентрацию гидроксид-ионов в растворе (моль/л).
1) – lgl0–11, 2) Igl0–3, 3) 10–11, 4) 10–3.
137. Чему равна концентрация ионов [Н+] в нейтральном растворе?
1) 1, 2) 0, 3) 7, 4) 10–14, 5) 10–7.
138. Чему равен рН 0,001 н. раствора хлороводородной кислоты (степень диссоциации принять равной 100%)?
1) 1, 2) 2, 3) 3, 4) –2.
139. Какая из приведенных концентраций соответствует кислой среде?
1) [ОН–] = 10–10 моль/л, 2) [Н+] = 10–10 моль/л, 3) [ОН–] = 10–3 моль/л, 4) [Н+] = 10–12 моль/л.
140. Рассчитать рОН, если рН равен 8.
1) 10, 2) 8, 3) 6, 4) 4.
141. Укажите, какие из перечисленных солей будут подвергаться гидролизу?*
а) КС1, б) NaCN, в) CH3COONa, г) NaNО3, д) Ca(NО3)2.
1) а, д, 2) б, г, 3) б, в, 4) в, г, 5) б, д.
142. Укажите, какие из перечисленных солей не подвергаются гидролизу?
a) NH4NО3, б) А1С13, в) Na2SО4, г) ВаСl2, д) К3РO4,
1) а, в, 2) б, г, 3) а, д, 4) в, г, 5) а, г.
143. Укажите, какие из перечисленных солей полностью гидролизуются?
a) Fe2(CO3)3, б) A12(SO4)3, в) FeCl3, г) A12S3, д) K2S.
1) а, б, 2) а, г, 3) б, г, 4) в, д, 5) б, д.
* Ответ подтвердите уравнением реакции.
144. Укажите, растворы каких из перечисленных солей будут иметь значение рН меньше 7:*
а) К3РO4, б) А1Сl3, в) ВаСl2, г) Cu(NO3)2, д) K2S.
1) б, г, 2) а, б, 3) б, в, 4) в, г, 5) г, д.
145. Укажите, растворы каких из перечисленных солей будут иметь, значение рН больше 7? *
a) (NH4)2SO4; б) Mg(NO3)2, в) Cr2(SO4)3, г) K2S, д) Na2CO3.
1) а, б, 2) б, в, 3) в, д, 4) в, г, 5) г, д.
146. От каких из перечисленных факторов:
а) природа соли, б) концентрация, в) температура, г) давление,
д) природа растворителя – не зависит степень гидролиза?
1) а, г, 2) б, в, 3) в д, 4) г, 5) от всех перечисленных.
147. От каких из перечисленных факторов:
а) концентрация, б) температура, в) давление, г) присутствие одноименных ионов, д) рН среды – зависит константа гидролиза?
1) а, 2) б, 3) в, г, 4) г, д, 5) в, д.
148. Что следует написать в правую часть сокращенного ионного уравнения гидролиза хлорида железа(III) по первой ступени? *
1) Fe(OH)3 + H+; 2) Fe(OH) 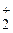 + H+, 3) FeOH2+ + Cl–,4) Fe3+ + Cl–;
+ H+, 3) FeOH2+ + Cl–,4) Fe3+ + Cl–;
5) FeOH2+ + H+; 6) Fe(OH)3 + HCl.
149. Что следует написать в правую часть сокращенного ионного уравнения гидролиза хлорида аммония?
1) NH4OH + HCl; 2) NH 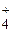 + С1–, 3) NH4OH + H+;
+ С1–, 3) NH4OH + H+;
4) NH 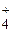 + HC1; 5) OH– + H+.
+ HC1; 5) OH– + H+.
150. Укажите фактор, усиливающий гидролиз соли.
1) увеличение концентрации, 2) уменьшение концентрации,
3) влияние одноименного иона, 4) понижение температуры.
1.8. Окислительно-восстановительные реакции
Пример 1. Какие из приведенных ниже реакций являются окислительно-восстановительными? Укажите для каждой из них окислитель и восстановитель.
1. Fe + 2HCl = FeCl2 + H2.
2. FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl.
3. Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3.
4. 2KI + Cl2 = 2KCl + I2.
Решение. Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов. Степень окисления – это условный заряд, появляющийся на атоме в результате смещения электронного облака к более электроотрицательному атому. Степень окисления может быть отрицательной, положительной и нулевой.
Окисление – это процесс отдачи электронов, сопровождающийся повышением степени окисления. Атомы, молекулы и ионы, отдающие электроны, называются восстановителями.
Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления. Атомы, молекулы и ионы, принимающие электроны, называют окислителями.
Определим степени окисления атомов.
1. 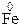 + 2
+ 2 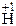 Cl =
Cl = 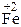 Cl2 +
Cl2 + 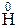 2.
2.
Железо и водород меняют степени окисления. Следовательно, данная реакция относится к окислительно-восстановительным:
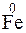 - 2
- 2 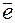 =
= 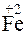 – процесс окисления, железо – восстановитель.
– процесс окисления, железо – восстановитель.
2 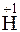 + 2
+ 2 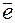 =
=  2 – процесс восстановления, ион водорода – окислитель.
2 – процесс восстановления, ион водорода – окислитель.
2. 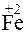
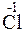 2 + 2
2 + 2 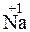
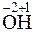 =
= 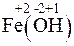 2 + 2
2 + 2 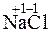 .
.

Степени окисления атомов в веществах не изменяются, поэтому реакция не является окислительно-восстановительной.
3. 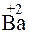 (
(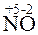 3)2 +
3)2 + 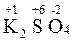 = 2
= 2 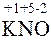 3 +
3 + 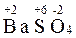
Эта реакция также не относится к окислительно-восстановительным, степени окисления атомов постоянны.
4. 2K  +
+ 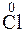 2 = 2K
2 = 2K 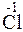 +
+ 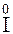 2.
2.
Хлор и йод меняют степени окисления, это - окислительно-восстано-вительная реакция:
2 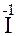 -2
-2 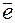 =
= 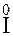 2– процесс окисления, ион йода – восстановитель,
2– процесс окисления, ион йода – восстановитель,
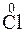 2 + 2
2 + 2 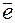 = 2
= 2 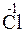 – процесс восстановления, молекула хлора – окислитель.
– процесс восстановления, молекула хлора – окислитель.
Пример 2. Какой процесс окисления или восстановления происходит при следующих превращениях:
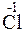
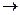
 ;
; 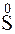
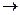
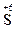 ;
; 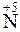
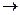
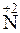 ;
;
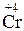
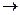
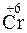 ;
; 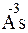
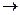
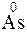 ;
; 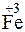
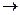
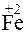 ?
?
Решение. Повышение степени окисления происходит в результате отдачи электронов (окисления), понижение – за счет присоединения электронов (восстановления):
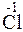
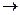
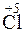
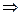
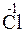 - 6
- 6 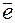 =
= 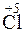 – окисление,
– окисление,
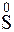
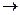
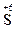
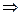
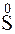 - 8
- 8 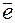 =
= 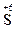 – окисление,
– окисление,
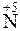
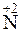
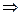
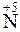 + 3
+ 3 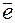 =
= 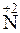 – восстановление,
– восстановление,
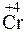
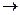
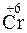
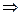
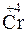 - 2
- 2 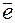 =
= 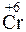 – окисление,
– окисление,
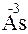
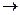
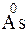
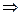
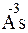 - 3
- 3 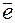 =
= 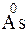 – окисление,
– окисление,
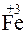
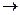
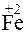
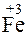 + 1
+ 1 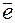 =
= 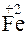 – восстановление.
– восстановление.
Пример 3. Реакция выражается схемами:
1. KClO3 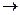 KClO4 + KCl.
KClO4 + KCl.
2. (NH4)2S + K2Cr2O7 + H2O 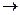 S + Cr(OH)3 + NH3 + KOH.
S + Cr(OH)3 + NH3 + KOH.
Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
Решение. Для подбора коэффициентов уравнения воспользуемся методом электронного баланса.
1. Записываем уравнение реакции и находим атомы, меняющие степень окисления:
K 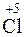 O3 ® K
O3 ® K 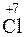 O4 + K
O4 + K 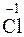 .
.
2. Составляем электронные уравнения и находим окислитель и восстано-витель:
Cl+5 – 2  = Cl+7, Cl+5 – восстановитель,
= Cl+7, Cl+5 – восстановитель,
Cl+5 + 6  = Cl–1, Cl+5 – окислитель.
= Cl–1, Cl+5 – окислитель.
В этом уравнении Cl+5(KClO3) является одновременно и окислителем, и восстановителем. Такая окислительно-восстановительная реакция называется реакцией диспропорционирования (самоокисления-самовосстановления).
3. Находим коэффициенты для окислителя, восстановителя и продуктов их превращения. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Для этого находим наименьшее общее кратное и множители:

 Cl+5 – 2
Cl+5 – 2  = Cl+7 3 (1)
= Cl+7 3 (1)
Cl+5 + 6  = Cl– 1 (2)
= Cl– 1 (2)
Ставим эти множители в уравнение (1). Перед KClO3 (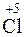 ) ставится суммарный множитель (3 + 1 = 4). Коэффициенты у формул остальных веществ подбираются как обычно, путем сопоставления числа атомов в правой и левой частях уравнения:
) ставится суммарный множитель (3 + 1 = 4). Коэффициенты у формул остальных веществ подбираются как обычно, путем сопоставления числа атомов в правой и левой частях уравнения:
4KClO3 = 3KClO4 + KCl.
По той же методике расставим коэффициенты во втором уравнении:
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1018; Нарушение авторских прав?; Мы поможем в написании вашей работы!