
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы неэлектролитов
|
|
|
|
Пример 1. Вычислить осмотическое давление раствора глицерина, содержащего 0,46 г глицерина в 100 мл раствора при 20 °С.
Решение. По закону Вант-Гоффа
Pосм. = CRT,
где С – концентрация вещества в молях на литр раствора (молярная);
Т – абсолютная температура; R – универсальная газовая постоянная
R = 8,314 Дж/моль К; Росм. – осмотическое давление раствора.
Молярная концентрация С определяется из соотношения:
С = 
где n – число молей растворенного вещества в данном объеме раствора; g – масса растворенного вещества в граммах; V – объем раствора в литрах; М – молекулярная масса растворенного вещества.
Тогда:
Росм. =  Росм. =
Росм. =  .
.
Росм. = 121,7 Па=1,2 атм
Пример 2. Раствор, содержащий 0,48 г глицерина на 25 г воды, замерзает при температуре –0,387°С. Вычислить молекулярную массу глицерина и осмотическое давление раствора при 0 °С.
Решение. а) Определение молекулярной массы глицерина.
Dt = K×Сm,
где К – криоскопическая константа, равная для водных растворов
1,86 °С; Сm – моляльная концентрация (число молей растворенного веществана 1000 г растворителя).

где m – масса растворенного вещества в граммах; m1 – масса растворителя в граммах; М – молекулярная масса вещества.
Dt = 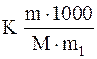 , M =
, M = 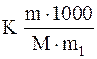 ,
,
Dt = 00 – (–0,3870) = 0,3870,
M =  , M = 92.
, M = 92.
б) Определение осмотического давления.
Осмотическое давление раствора вычисляется с помощью уравнений:
Росм. = CRT и Dt = K×Cm. Сm = 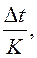
Росм. =  Росм. =
Росм. =  Росм = 4,67 атм.
Росм = 4,67 атм.
Пример 3. Вычислите температуры кристаллизации и кипения раствора с массовой долей сахара C12H22O11 5 %.
Решение. При растворении в растворителе нелетучего вещества давление пара растворителя над раствором уменьшается, что вызывает повышение температуры кипения раствора и понижение температуры его замерзания по сравнению с чистым растворителем. При этом, согласно закону Рауля, повышение температуры кипения (Dtкип.) и понижение температуры замерзания (Dtзам.) раствора пропорционально моляльной концентрации раствора:
Dtк = Э · Cm, Dtз = К · Сm.
Здесь Cm - моляльная концентрация раствора (число молей растворенного вещества в 1000 г растворителя); Э - эбуллиоскопическая константа растворителя, град; К - криоскопическая константа растворителя, град.
Так как молярная концентрация равна:  ,
,
где m - масса растворенного вещества, г; M - молярная масса растворенного вещества, г/моль; m1 - масса растворителя, г, то формулы закона Рауля можно записать следующим образом:
Dtк =  , Dtз =
, Dtз =  .
.
Эти формулы позволяют определить температуры замерзания и кипения растворов по их концентрации, а также находить молекулярную массу растворенного вещества по понижению температуры замерзания и повышению температуры кипения раствора.
Для воды криоскопическая константа (К) и эбуллиоскопическая константа (Э) соответственно равны 1,86 и 0,52 град. Молярная масса сахара 342 г/моль. Рассчитаем понижение температуры кристаллизации раствора с массовой долей сахара 5 %:
Dtз =  = 0,29 °С.
= 0,29 °С.
Вода кристаллизуется при 0 °С, следовательно, температура кристаллизации раствора будет 0 - 0,29 = - 0,29 °С.
Из формулы рассчитываем повышение температуры кипения этого раствора:
Dtк =  = 0,06 °С.
= 0,06 °С.
Вода кипит при 100 °С. Следовательно, температура кипения этого раствора будет 100 + 0,06 = 100,06 °С.
Пример 4. Рассчитайте, при какой температуре будет кристаллизоваться раствор, содержащий в 200 г бензола, 12 г нафталина?
Решение. Криоскопическая константа бензола равна 5,10 град. Молярная масса нафталина C10H8 = 128 г/моль. Из формулы понижение температуры замерзания этого раствора
Dtз =  = 2,38 °С.
= 2,38 °С.
Бензол кристаллизуется при 5,53 °С. Таким образом, температура крис-таллизации раствора равна: 5,5 - 2,38 = 2,15 °С.
Пример 5. В каком количестве воды следует растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 °С?
Решение. Температура кипения воды 100 °С. Повышение температуры кипения раствора Dtк = 100,2 - 100 = 0,2 °С. Молярная масса глюкозы C6H12O6 - 180 г/моль.
Из формулы находим количество воды, в котором нужно растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 °С:
Dtк = 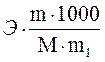 ,
, 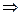 m1 =
m1 = 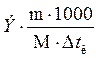 , =
, = 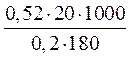 = 289 г.
= 289 г.
Пример 6. При растворении 6,9 г глицерина в 500 г воды температура замерзания понизилась на 0,279 °С. Определите молярную массу глицерина.
Решение. Для расчета молярной массы глицерина преобразуем формулу и подставим известные величины:
Dtз =  .
. 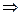 M =
M =  =
=  =
=
92 г/моль.
Здесь 1,86 - криоскопическая константа воды.
Задания
101–110. Для приведенных ниже растворов рассчитайте осмотическое давление при 20 °С и молекулярную массу растворенного вещества (среднюю для биологических объектов), руководствуясь данными таблицы №7:
Таблица №7 – Данные для задач 101–110
| № задачи | Раствор | Концентрация | Dtзамерз. | Криоскопическая константа | Молекулярная масса |
| Вода/моноса-харид | 3,6 % | 0,385 | 1,86 | ? | |
| Вода/мочевина | 7,24 % | 2,420 | 1,86 | ? | |
| Вода/дисахарид | 68,4 % | 6,510 | 1,86 | ? | |
| Вода/спирт | 0,79 % | 0,354 | 1,86 | ? | |
| Вода/поливини-ловый спирт | 5,33 г на 257 г Н2О | 0,113 | 1,86 | ? | |
| Клеточный сок | Изотоничен с 7 % раствором глюкозы | 0,620 | 1,86 | ? | |
| Клеточный сок | Изотоничен с 4 % раствором сахарозы | 0,760 | 1,86 | ? | |
| Сера (S8)/бензол | 18 г серы, 25 г С6Н6 | 0,514 | ? | 32×8 | |
| Кровь | Изотоничнас 0,34 М раствором неэлектролита | 0,540 | 1,86 | ? | |
| Ацетон/уксус-ная кислота | 0,502 г ацетона + 100 г кислоты | 0,339 | ? |
111. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296 °С. Температура кристаллизации бензола
5,5 °С. Криоскопическая константа 5,1 град. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль.
112. Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная температуру кристаллизации раствора (–0,93 °С). Криоскопическая константа воды 1,86 град. Ответ: 14,6 %.
113. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при –0,279 °С. Криоскопическая константа воды 1,86 град. Ответ: 60 г/моль.
114. Вычислите температуру кипения раствора с массовой долей нафталина С10Н8 в бензоле 5 %. Температура кипения бензола 80,2 °С. Эбуллиоскопическая константа его 2,57 град. Ответ: 81,25°С.
115. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465 °С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 град.
Ответ: 342 г/моль.
116. Сколько граммов анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 0С. Эбуллиоскопическая константа этилового эфира 2,12 град. Ответ: 1,16 г.
117. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465 0C? Криоскопическая константа воды 1,86 град. Ответ: 1,12 г,
118. Сколько граммов мочевины (NH2)2CO следует растворить в
250 г воды, чтобы температура кипения повысилась на 0,26 °С? Эбуллиоскопическая константа воды 0,52 град. Ответ: 7,5 г.
119. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372 0С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 град. Ответ: 92 г/моль.
120. Вычислите массовую долю метанола CH3OH в водном растворе, температура кристаллизации которого –2,79 °С. Криоскопическая константа воды 1,86 град. Ответ: 4,58 %.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 5564; Нарушение авторских прав?; Мы поможем в написании вашей работы!