
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цели и задачи изучения темы. Тема 3.1 Спектральный рентгеновский микроанализ
|
|
|
|
Тема 3.1 Спектральный рентгеновский микроанализ
Резюме по теме
Электронная микроскопия, на основе волновых свойств движущихся электронов, позволяет получать изображение нанообъектов. Пространственное разрешение электронных микроскопов достигает 0,1 нм. Специальные методы подготовки биологических препаратов, среди которых важное значение имеют способы фиксации с сохранением прижизненных особенностей клеточных и субклеточных образований, дают возможность изучения тонких структурных особенностей клеток и клеточных органелл с выяснением закономерностей их жизнедеятельности. Сканирующая электронная микроскопия позволяет оценить топографию поверхности мембранных образований.
РАЗДЕЛ 3 АНАЛИТИЧЕСКАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ

Рис. 47. Приставка рентгеновского спектрального анализа.
Цель: формирование знаний о возможностях использования специальных приставок для проведения рентгеновского микроанализа к электронным микроскопам.
Задачи:
· изучение принципа работы и устройства спектрометров;
· оценка возможностей использования рентгеновского микроанализа для изучения элементного состава биологических объектов.
При помощи специальных приставок спектрального рентгеновского анализа (XEDS - X-rays Energy Dispersive Spectometry), монтирующихся как на ПЭМ, так и на РЭМ появляется возможность изучения локализации и локальной концентрации элементов в клетке и ее ультраструктурах. Метод основан на регистрации и анализе энергетических спектров характеристического рентгеновского излучения возбуждаемого проходящими через образец электронами. В рентгеновском микроанализаторе объект сканируется тонким пучком электронов. Взаимодействие такого зонда с объектом вызывает рентгеновское излучение, позволяющее идентифицировать химические элементы.
Спектрометры включают три основных компонента: детектор, соответствующую электронику спектрального анализа и дисплей многоканального анализатора.
С помощью имеющихся в настоящее время детекторов минимальное количество элемента в биологической ткани, которое может быть измерено с помощью рентгеновского микроанализа, составляет приблизительно 10-19 г при пространственном разрешении 20— 30 нм и пределе разрешения в массовых долях порядка 1 мМ/кг. Детектор генерирует зарядовые импульсы, амплитуда которых пропорциональна энергии рентгеновского кванта. Зарядовый импульс конвертируется в импульс напряжения и усиливается с помощью полевого транзистора (FET), изолируется от других (следующих) импульсов, усиливается больше, проверяется, что он принадлежит рентгеновскому спектру, конвертируется в код (с помощью аналого-цифрового преобразователя - АЦП или ADC) и запоминается в соответствующем канале энергетического спектра в многоканальном анализаторе (МКА или МСА).
Полупроводниковые детекторы (ППД) рентгеновского излучения (РИ). Детектор в XEDS - это диод с обратным смещением. Практически все аналитические электронные микроскопы используют Si(Li)-полупроводниковые детекторы (ППД). В некоторых ПЭМ промежуточных энергий используются Ge собственной проводимости (intrinsic Ge - IG) ППД. Si(Li)-ППД требуют охлаждения до температуры жидкого азота.
Электроника ППД-спектрометра. Первым в цепи устройств усиления находится FE-транзистор который преобразует зарядовый импульс в амплитудный. Этот аналоговый сигнал усиливается в несколько тысяч раз и преобразуется в вид удобный для конвертирования в число (код), пропорциональное амплитуде (и, следовательно, энергии РИ) с помощью АЦП.
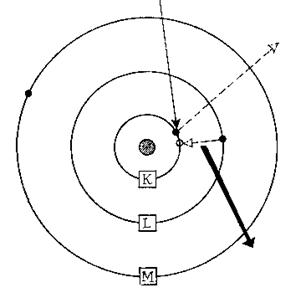
Рис. 48. Образование рентгеновских лучей.
Физические основы процесса возбуждения характеристического рентгеновского излучения в объекте. При возбуждении электронным пучком падающие электроны, ударяя по электронным внутренним оболочкам атомов (К-уровня), выбивают электроны с орбиты энергетического уровня. В результате этого процесса создаются вакансии, для заполнения которых используются электроны с более высоких энергетических уровней (L- или М-уровня). Поскольку энергия у этих электронов выше энергии выбитого электрона, то избыток энергии высвечивается в виде квантов рентгеновского излучения. Различие между двумя энергетическими уровнями является энергией, которая характеризует элемент. Один электрон может отдать всю или только часть своей энергии при единичном столкновении; обычно он подвергается нескольким столкновениям, поскольку проходит образец до тех пор, пока его скорость не уменьшится до нулевой.
После многократных переходов электронов образуется спектр характеристического излучения. Поскольку вероятности электронных переходов различны, то число фотонов, эмитированных в результате различных электронных переходов, различается. Вследствие этого конечный спектр излучения будет иметь вид гауссова распределения.
С помощью метода Монте-Карло показано, что при взаимодействии падающих электронов с образцами, имеющими в своем составе элементы с большими атомными номерами, образуется объем возбуждения в виде полусферы. С увеличением плотности образца, падающие электроны неглубоко проникают в образец, образуя много диффузионных электронов около поверхности. Большинство биологических объектов состоит из элементов с низкими атомными номерами. По этой причине падающие электроны проникают глубоко в образец, где они теряют свою энергию и располагаются в пространстве, имеющем форму капли.
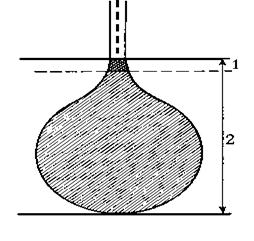
Рис. 49. Форма пространства, из которого происходит генерация рентгеновского излучения в ультратонких (1) и объемных (2) образцах.
С ростом ускоряющего напряжения происходит увеличение глубины и диаметра этой капли. Для сбора рентгеновских спектров используют несколько режимов оперирования: анализ точки (стационарный режим), режим сканирования по линии и сканирующий режим по плоскости.
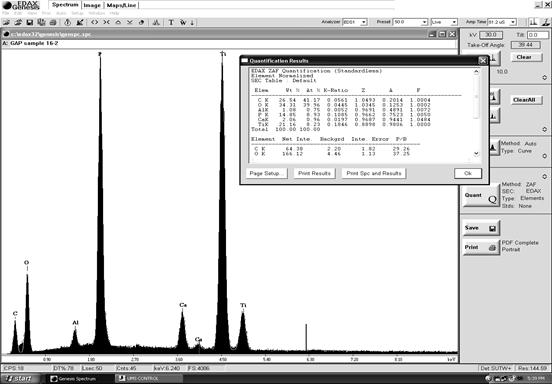
Рис. 50. Пример спектра рентгеновского излучения.
Режим анализа точки. На выбранный участок образца направляют сфокусированный луч и производят сбор спектра, при этом, чем меньше диаметр луча, тем меньше будет генерироваться рентгеновских лучей, что сильно затруднит регистрацию.
Режим сканирования по линии. Луч непрерывно скользит вдоль одной и той же линии, собирается спектр распределения элементов по этой линии. В ходе сканирования можно провести наложение кривой распределения на изображение объекта.
Режим сканирования по площади. Луч движется по одному и тому же месту определенное время (от 100 с и более), рентгеновские лучи собираются и с помощью специального преобразователя выдаются на электронно-лучевую трубку микроскопа. В ходе сканирования регистрируются все изменения на электронно-лучевой трубке в виде точек, формируя картину рентгеновского изображения, на которой большей концентрации выбранного элемента будет соответствовать большая густота расположения этих точек.
Важным показателем, влияющим на пространственное разрешение рентгеновского микроанализа, является толщина образцов. Так как объем возбуждения рентгеновского излучения представляет собой каплю, которая в верхней своей части имеет узкий участок, рентгеновский микроанализ может быть проведен как в трансмиссионном, так и в сканирующем электропонном микроскопе, который снабжен детектором трансмиссионных электронов или же специальным переходным устройством, позволяющим использовать один и тот же детектор вторичных электронов и для сканирующего, и для трансмиссионного режима работы. Однако разрешение сканирующего электронного микроскопа примерно в 10 раз ниже разрешения трансмиссионного микроскопа. Тем не менее, исследование в трансмиссионном режиме сканирующего микроскопа обладает некоторым преимуществом. Во-первых, в нем можно исследовать более толстые образцы (срезы до 5 мкм), что удобно для обнаружения элементов, присутствующих в тканях в небольших количествах. Обычно для анализа достаточна толщина срезов 0,1—0,2 мкм. Во-вторых, в большой камере сканирующего микроскопа легче разместить устройства для анализа образцов при температуре жидкого азота. В-третьих, изображение в сканирующем микроскопе гораздо контрастнее, а это обстоятельство может иметь большое значение, так как уменьшение или полный отказ от использования химических веществ для контрастирования более желателен при проведении микроанализа.
Основные направления применения метода:
· локализация ионов и электролитов известных физиологических функций;
· изучение систем, которые подвергались искусственно вызванным или естественным изменениям, например лекарствами, болезнью, гистохимическими красителями и преципитирующими агентами;
· локализация энзимной активности;
· микрохимический анализ очень малых объемов выжатых или извлеченных физиологических жидкостей;
· взаимосвязь элементного состава с конкретной морфологической особенностью;
· общее распределение ионов и элементов в нормальных растительных и животных клетках.
Преимущества рентгеновского микроанализа по сравнению с другими видами количественного анализа:
1) анализ с помощью рентгеновского излучения является достаточно щадящим для объекта;
2) анализируемое вещество может находится в различных агрегатных состояниях;
3) определение содержания всех присутствующих в объекте химических элементов можно осуществлять одновременно с помощью рентгеновского микроанализа, если использовать энергетический детектор;
4) можно производить анализ в широком диапазоне концентраций (практически от 10-4 до 100%-ной);
5) содержание элементов можно определять в очень малом объеме (порядка нескольких пиколитров).
В современной электронной микроскопии в биологических исследованиях используют два метода рентгеновского аналитического микроанализа: качественный и количественный. Качественный анализ, определяет наличие элемента в клетке или ткани. Количественный анализ, измеряет содержание – больше или меньше исследуемого элемента находится в одной и другой части клетки или ткани, т.е. определяет, какое количество данного элемента присутствует в данном объеме ткани. Существует несколько подходов для количественного микроанализа. Выбор их зависит от толщины образца и методов его подготовки. Для объектов толщиной до 10-15 мкм пригодна следующая формула:
Сх = Ix I Ixs,
где Сх — концентрация элемента х в анализируемом микрообъеме образца (в действительности масс-фракция данного элемента); Ix — измеряемая интенсивность выбранной характеристической линии данного элемента; Ixs — интенсивность той же линии (того же диапазона энергий) эталона, содержащего элемент х в известной концентрации.
Условия анализа должны быть идентичными. Для этого вводят факторы коррекции (ZAF -факторы), тогда более точная с физической точки зрения формула соотношения масс-фракций элемента и интенсивности приобретает вид:
Сх = Ix I Ixs ZAF,
где Z — фактор коррекции, учитывающий разницу среднего атомного номера элементов, составляющих объект и эталон; А — фактор коррекции, учитывающий внутреннюю адсорбцию образованных рентгеновских лучей объектом и эталоном; F — фактор, учитывающий флюоресценцию рентгеновских лучей, которые образовались не под действием электронного пучка. Другой подход был разработан специально для биологических объектов. Выведено следующее уравнение:
Сx= K Ix/Iw,
Здесь Iw — интенсивность рентгеновского излучения вблизи от характеристической линии элемента х, где отсутствуют какие-либо пики других элементов; К — константа, определяемая по эталону. Близость энергий Ix и Iw делает ненужным использование А- фактора коррекции, а наличие соотношения Ix/Iw — Z-фактора коррекции. F-фактор коррекции (для флюоресценции) обычно незначителен в случае биологических объектов.
В настоящее время большинство аналитических методов количественного анализа входят в пакет программ поставляемых к электронным микроскопам для РМА.
Для определения концентрации элементов необходимо с помощью соответствующих эталонов, содержащих известное количество элементов в определенной пропорции, выявить соотношение между концентрацией данного элемента и интенсивностью рентгеновского излучения. При РМА биологических объектов используют разнообразные эталоны. Для удобства их можно разделить на несколько типов: неорганические, смеси неорганических веществ со смолами, смеси органических веществ с электролитами, макроциклические полиэфирные комплексы с неорганическими солями, ткани и их гомогенаты с добавлением солей или без него, растворы электролитов. Наиболее широко используют смеси органических растворов (альбумина, желатины, агар-агара, декстрина и их комбинации) с неорганическими или органическими солями. В качестве эталонов используют также органометаллические или органометаллоидные вещества, заключенные в эпон. Органические стандарты основаны на свойстве макроциклических полиэфиров образовывать комплексы с натрием и калием. Однако оба эти метода применяют для приготовления стандартов лишь при исследовании тканей, залитых в смолу, ввиду того что одним из требований, предъявляемых к эталонам, является максимальная идентичность его матрикса по плотности с исследуемым объектом.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 640; Нарушение авторских прав?; Мы поможем в написании вашей работы!